Στοιχεία για το κάλιο 1
Το κάλιο είναι το 19 στοιχείο του περιοδικού πίνακα. Αυτό το στοιχείο θα το βρείτε στις μπανάνες, σε ορισμένα είδη σαπουνιού και στα λιπάσματα. Αυτά τα στοιχεία για το κάλιο περιέχουν χημικά και φυσικά δεδομένα μαζί με γενικές πληροφορίες και ιστορικό.

Βασικά στοιχεία για το κάλιο
Όνομα: Κάλιο
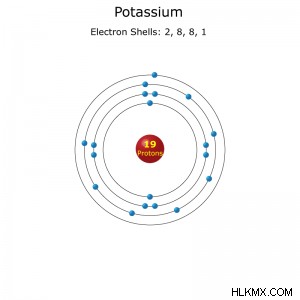
Ατομικός αριθμός: 19
Σύμβολο στοιχείου: K
Ομάδα: 1
Περίοδος: 4
Αποκλεισμός: s
Οικογένεια στοιχείων: Αλκαλιμέταλλο
Ατομική μάζα: 39.0983(1)
Διαμόρφωση ηλεκτρονίου: [Ar]4sFull:1s2s2p3s3p4s(full)
Ανακάλυψη: Ο Sir Humphry Davy το 1807
Ο Ντέιβι είναι γνωστός για τα πειράματά του στην ηλεκτρόλυση. Τοποθετούσε το όργανό του σε δείγματα διαφόρων κοινών χημικών ουσιών και παρατηρούσε τι συγκεντρώνεται στα ηλεκτρόδια. Απομόνωσε καθαρό μέταλλο καλίου από ποτάσα (υδροξείδιο του καλίου).
Προέλευση ονόματος: Το κάλιο ονομάστηκε από την πηγή του:ποτάσα. Η ποτάσα σχηματίστηκε από στάχτες ξύλου εμποτισμένες σε νερό.
Προέλευση συμβόλου στοιχείου: Το σύμβολο Κ για το κάλιο προέρχεται από τη λατινική ονομασία της ποτάσας, kalium. Γερμανοί και Σκανδιναβοί χημικοί χρησιμοποίησαν το όνομα kalium για το κάλιο στα κείμενα και τα περιοδικά τους.
Ισότοπα:
Το φυσικό κάλιο αποτελείται από τρία ισότοπα:Κ, Κ και Κ.
Υπάρχουν δύο σταθερά και είκοσι δύο ραδιενεργά ισότοπα που κυμαίνονται από Κ έως Κ.
κ
Το κάλιο-39 είναι ένα σταθερό ισότοπο που περιέχει 20 νετρόνια. Το 93,2581% του φυσικού καλίου είναι κάλιο-39.
κ
Το κάλιο-40 είναι ένα ραδιενεργό ισότοπο που περιέχει 21 νετρόνια. Τις περισσότερες φορές, το κάλιο-40 διασπάται με β- διάσπαση σε Ca, αλλά μπορεί επίσης να διασπάσει τη διάσπαση β+ ή τη σύλληψη ηλεκτρονίων σε Ar με χρόνο ημιζωής 1,2 δισεκατομμύρια χρόνια. Το κάλιο-40 αντιπροσωπεύει το 0,117% του φυσικού καλίου.
κ
Το κάλιο-41 είναι ένα σταθερό ισότοπο που περιέχει 22 νετρόνια. Το 6,7302% του φυσικού καλίου είναι κάλιο-39.

Φυσικά δεδομένα
Πυκνότητα: 0,89 g/cm
Σημείο τήξης: 336,7 K(63,5 °C, 146,3 °F)
Σημείο βρασμού: 1032 K(759 °C, 1398 °F)
Κρίσιμο σημείο: 2223 K στα 16 MPa
Κατάσταση στους 20ºC: Στερεά
Heat of Fusion: 2,33 kJ/mol
Θερμότητα εξάτμισης: 76,9 kJ/mol
Μοριακή θερμική χωρητικότητα: 29,6 J/mol·K
Ατομικά δεδομένα
Ατομική ακτίνα: 2,27 Å (εμπειρικό)
Ομοιοπολική ακτίνα: 2,03 Å
Ακτίνα Van der Waals: 2,75 Å
Συγγένεια ηλεκτρονίων: 48,385 kJ/mol
Ηλεκτραρνητικότητα: 0,82
1 Ενέργεια Ιονισμού: 418,81 kJ/mol
2 Ενέργεια Ιονισμού: 3051,83 kJ/mol
3 Ενέργεια Ιονισμού: 4419,607 kJ/mol
4 Ενέργεια Ιονισμού: 5876,92 kJ/mol
5 Ενέργεια Ιονισμού: 7975,48 kJ/mol
6 Ενέργεια Ιονισμού: 9590,6 kJ/mol
7 Ενέργεια Ιονισμού: 11995.347 kJ/mol
8 Ενέργεια Ιονισμού: 13841,79 kJ/mol
Καταστάσεις οξείδωσης: +1 (κοινό), -2 (ασυνήθιστο)

Διασκεδαστικά στοιχεία για το κάλιο
- Το κάλιο είναι ένα γυαλιστερό, λαμπερό μέταλλο σε θερμοκρασία δωματίου. Όταν εκτίθεται στον αέρα, ένα οξειδωτικό στρώμα σχηματίζεται γρήγορα, μετατρέποντας την εμφάνισή του σε ένα θαμπό γκρι.
- Το κάλιο αντιδρά έντονα με το νερό για να σχηματίσει αέριο υδρογόνο. Αυτό το αέριο μπορεί να αναφλεγεί από την ενέργεια που απελευθερώνεται από την αντίδραση, δίνοντας την εντύπωση ότι το κάλιο καίγεται στο νερό.
- Το κάλιο ήταν το πρώτο μέταλλο που ανακαλύφθηκε με ηλεκτρόλυση.
- Το κάλιο έχει χαμηλή πυκνότητα για ένα μέταλλο. Το καθαρό μέταλλο καλίου θα επιπλέει στο νερό.
- Το κάλιο καίγεται με έντονο κόκκινο σε μια δοκιμή φλόγας. Όταν βρίσκεται στο νερό, η φλόγα παίρνει μια λιλά απόχρωση.
- Το κάλιο είναι το έβδομο πιο άφθονο στοιχείο στο ανθρώπινο σώμα.
- Το κάλιο είναι το έβδομο πιο άφθονο στοιχείο στον φλοιό της Γης, αντιπροσωπεύοντας το 4,2% κατά μάζα.
- Η μεγαλύτερη βιομηχανική χρήση του καλίου είναι για λίπασμα.
- Το κάλιο χρησιμοποιείται στα σαπούνια, την πυρίτιδα, τα λευκαντικά και την παραγωγή γυαλιού.
- Το κάλιο-40 χρησιμοποιείται όπως ο άνθρακας-14 ως δείκτης ραδιενεργού χρονολόγησης. Το K-40 χρησιμοποιείται για τον προσδιορισμό της ηλικίας των πετρωμάτων.
Μάθετε περισσότερα σχετικά με τα στοιχεία στον περιοδικό πίνακα.




