Διαφορά μεταξύ οξέος και αλκαλικού
Κύρια διαφορά – Οξύ έναντι αλκαλικού
Τα οξέα και τα αλκαλικά είναι δύο όροι που απαντώνται συχνά στην υδρόβια χημεία. Τα οξέα είναι χημικά είδη που παρουσιάζουν όξινα χαρακτηριστικά. Το αλκαλικό είναι ένας τύπος βάσης. Επομένως, τα αλκαλικά διαλύματα παρουσιάζουν βασικές ιδιότητες. Η κύρια διαφορά μεταξύ Οξέος και Αλκαλικού είναι ότι το το pH των οξέων είναι κάτω από pH 7 ενώ το pH των αλκαλικών είναι πάνω από pH 7 .
Βασικές περιοχές που καλύπτονται
1. Τι είναι το οξύ
– Ορισμός, Ιδιότητες, Παραδείγματα
2. Τι είναι αλκαλικό
– Ορισμός, Ιδιότητες, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ Οξέος και Αλκαλικού
– Σύγκριση βασικών διαφορών
Βασικοί όροι:οξύ, αλκάλιο, μέταλλα αλκαλίων γης, αλκαλικά, υδρόβια χημεία, βάσεις, οξύ Lewis, pH, ισχυρά οξέα, αδύναμα οξέα 
Τι είναι ένα οξύ
Το οξύ είναι ένα χημικό είδος που μπορεί να εξουδετερωθεί από μια βάση. Τα οξέα είναι ικανά να απελευθερώνουν πρωτόνια ή ιόντα Η σε υδατικά διαλύματα. Ένα οξύ μπορεί να διαχωριστεί στη συζευγμένη βάση του και στα ιόντα Η. Σύμφωνα με την ισχύ διάστασής τους, υπάρχουν δύο τύποι οξέων.
- Ισχυρά οξέα
- Ασθενή οξέα
Τα ισχυρά οξέα είναι ενώσεις που μπορούν να διασπαστούν πλήρως στα ιόντα τους. Τα αδύναμα οξέα είναι ενώσεις που διασπώνται μερικώς στα ιόντα τους. Επομένως, τα αδύναμα οξέα βρίσκονται σε ισορροπία με τη συζευγμένη βάση τους και τα ιόντα Η σε υδατικά διαλύματα.
Το pH ενός οξέος είναι πάντα κάτω από 7. Το pH 7 είναι το ουδέτερο pH ενός διαλύματος όπως το καθαρό νερό. Πολύ χαμηλές τιμές pH δίνονται από ισχυρά οξέα και τιμές pH που είναι κοντά στο pH 7 δίνονται από ασθενή οξέα. Ωστόσο, έχουν αυτές τις χαμηλές τιμές pH αφού τα οξέα δίνουν υψηλές ποσότητες ιόντων Η στο υδατικό διάλυμα και το pH είναι ο λογάριθμος της αντίστροφης συγκέντρωσης Η.
Επιπλέον, οι ενώσεις που μπορούν να δεχτούν ένα ζεύγος ηλεκτρονίων από έναν δότη είναι γνωστές ως οξύ Lewis . Σύμφωνα με αυτόν τον ορισμό, ορισμένες ενώσεις που δεν περιέχουν Η κατηγοριοποιούνται επίσης ως οξέα. Για παράδειγμα, AlCl3 Το (τριχλωριούχο αλουμίνιο) είναι ένα οξύ Lewis. Αυτό συμβαίνει επειδή το άτομο Al έχει κενά τροχιακά p που μπορούν να δεχτούν ένα εισερχόμενο ζεύγος ηλεκτρονίων από έναν δότη.
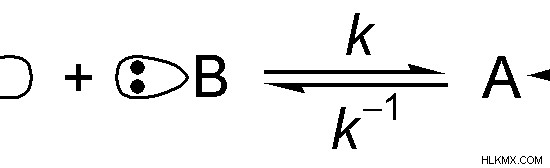
Εικόνα 01:Η αντίδραση μεταξύ ενός οξέος Lewis και μιας βάσης Lewis
Στην παραπάνω εικόνα, το "A" είναι μια χημική ένωση. Μπορεί να δεχθεί το μοναχικό ζεύγος ηλεκτρονίων του «Β». Επομένως, το "A" είναι ένα οξύ Lewis.
Κανονικά, τα οξέα έχουν ξινή γεύση και είναι διαβρωτικά στη συμπυκνωμένη τους μορφή. Μπορούν να μετατρέψουν την μπλε λακκούβα σε κόκκινο χρώμα. Τα περισσότερα οξέα μπορούν να αντιδράσουν με μέταλλα, σχηματίζοντας άλας και αέριο υδρογόνο (H2 ).
Τι είναι αλκαλικό
Το αλκαλικό είναι ένα διάλυμα που έχει τιμές pH πάνω από 7. Αυτό σημαίνει ότι τα αλκαλικά διαλύματα εμφανίζουν βασικές ιδιότητες. Επομένως, τα αλκαλικά διαλύματα μπορούν να εξουδετερωθούν με οξέα. Τα αλκαλικά διαλύματα έχουν πικρή γεύση και αισθάνονται ολισθηρά όταν τα αγγίζετε.
Ένα αλκαλικό διάλυμα σχηματίζεται όταν ένα αλκάλιο διαλύεται στο νερό. Το αλκάλι αναφέρεται σε οποιοδήποτε βασικό υδροξείδιο ή άλας αλκαλιμετάλλων ή μετάλλων αλκαλικών γαιών. Ο όρος αλκαλικό προέρχεται από τα μεταλλικά στοιχεία της ομάδας 1 και της ομάδας 2 στον περιοδικό πίνακα στοιχείων. Τα στοιχεία της ομάδας 1 ονομάζονται αλκαλικά μέταλλα. Τα μέταλλα της ομάδας 2 ονομάζονται μέταλλα αλκαλικών γαιών. Και οι δύο τύποι μετάλλων προκαλούν αύξηση του pH του νερού όταν προστίθενται στο νερό. Αυτό συμβαίνει επειδή, όταν ένα μέταλλο αλκαλίου ή μέταλλο αλκαλικής γαίας προστίθεται στο νερό, αντιδρά με μόρια νερού, σχηματίζοντας το υδροξείδιο μετάλλου και το H2 αέριο. Αυτό το υδροξείδιο μετάλλου προκαλεί αύξηση του pH του διαλύματος αφού αυξάνεται η συγκέντρωση των ΟΗΙόντων.

Εικόνα 02:Η αντίδραση μεταξύ νατρίου (Na) που είναι αλκαλικό μέταλλο και νερού (H2O)
Εκτός αυτού, τα αλκαλικά διαλύματα μπορούν να μετατρέψουν την κόκκινη λακκούβα σε μπλε χρώμα. Αυτό είναι μια ένδειξη της βασικότητας των αλκαλικών διαλυμάτων. Ορισμένα αλκαλικά διαλύματα είναι διαβρωτικά, αλλά μερικά όχι. Όλα τα αλκαλικά διαλύματα είναι βάσεις που διαλύονται στο νερό. Αλλά όλες οι βάσεις δεν είναι αλκαλικές επειδή ορισμένες βάσεις δεν διαλύονται στο νερό.
Η αμμωνία (NH3) κατηγοριοποιείται επίσης ως αλκαλική αν και δεν είναι υδροξείδιο ή άλας αλκαλικών μετάλλων. Αυτό συμβαίνει γιατί είναι πολύ καλά διαλυμένο στο νερό και το υδατικό του διάλυμα εμφανίζει βασικές ιδιότητες.
Διαφορά μεταξύ οξέος και αλκαλικού
Ορισμός
Οξύ: Ένα οξύ είναι ένα χημικό είδος που έχει pH κάτω από 7.
Αλκαλικό: Ένα αλκαλικό διάλυμα είναι μια χημική ουσία που έχει pH πάνω από 7.
Παρουσιάζονται ιόντα
Οξύ: Τα υδατικά διαλύματα οξέων αποτελούνται από ιόντα Η.
Αλκαλικό: Τα υδατικά διαλύματα αλκαλικών αποτελούνται από ιόντα ΟΗ.
Γεύση
Οξύ: Τα οξέα έχουν ξινή γεύση.
Αλκαλικό: Τα αλκάλια έχουν πικρή γεύση.
Υφή
Οξύ: Τα οξέα είναι κολλώδη.
Αλκαλικό: Τα αλκάλια είναι ολισθηρά.
Εξουδετέρωση
Οξύ: Τα οξέα μπορούν να εξουδετερωθούν με βάσεις.
Αλκαλικό: Τα αλκάλια μπορούν να εξουδετερωθούν με οξέα.
Συμπέρασμα
Τα οξέα και τα αλκαλικά είναι διαλύματα με χαμηλότερες και υψηλότερες τιμές pH, αντίστοιχα. Η κύρια διαφορά μεταξύ του Οξέος και του Αλκαλικού είναι ότι το pH των οξέων βρίσκεται κάτω από το pH 7 ενώ το pH του αλκαλικού είναι πάνω από το pH 7. Παίζουν πολύ σημαντικό ρόλο στον προσδιορισμό της οξύτητας και της αλκαλικότητας του νερού. Ως εκ τούτου, είναι πολύτιμες παράμετροι για τον έλεγχο της ποιότητας του νερού για πόσιμο και για άλλους σκοπούς.




