Endergonic vs Exergonic Reactions και Παραδείγματα
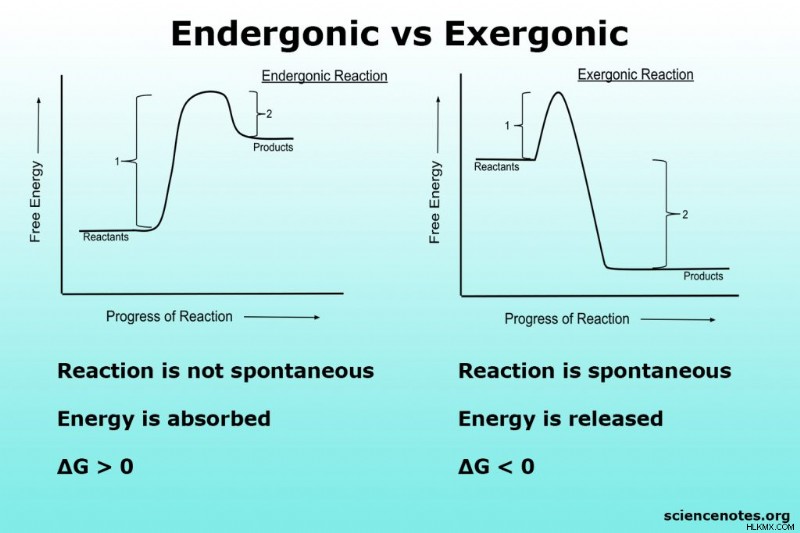
Οι Ενεργονικές και Εξεργονικές αντιδράσεις ορίζονται σύμφωνα με την αλλαγή στην ελεύθερη ενέργεια Gibbs. Σε μια ενεργονική αντίδραση, η ελεύθερη ενέργεια των προϊόντων είναι μεγαλύτερη από την ελεύθερη ενέργεια των αντιδρώντων ((∆G> 0, ενέργεια αποθηκεύεται στα προϊόντα), επομένως η αντίδραση δεν είναι αυθόρμητη και πρέπει να παρέχεται πρόσθετη ενέργεια για να γίνει η Σε μια εξεργονική αντίδραση, η ελεύθερη ενέργεια των αντιδρώντων είναι μεγαλύτερη από την ελεύθερη ενέργεια των προϊόντων (ΔG <0) Απελευθερώνεται ενέργεια στο περιβάλλον, η οποία υπερνικά την ενέργεια ενεργοποίησης της αντίδρασης και την καθιστά αυθόρμητη.
Ακολουθεί μια πιο προσεκτική ματιά στις ενεργονικές και εξεργονικές αντιδράσεις, παραδείγματα κάθε τύπου και πώς οι αντιδράσεις συνδέονται για να αναγκάσουν να συμβούν δυσμενείς αντιδράσεις.
Ενεργονικές αντιδράσεις
Μια ενεργονική αντίδραση είναι μια χημική αντίδραση με θετική τυπική ελεύθερη ενέργεια Gibbs, σε σταθερή θερμοκρασία και πίεση:
∆G°> 0
Με άλλα λόγια, υπάρχει καθαρή απορρόφηση ελεύθερης ενέργειας. Οι χημικοί δεσμοί στα προϊόντα αποθηκεύουν ενέργεια. Οι ενδογονικές αντιδράσεις ονομάζονται επίσης δυσμενείς ή μη αυθόρμητες αντιδράσεις, επειδή η ενέργεια ενεργοποίησης για μια ενεργονική αντίδραση είναι συνήθως μεγαλύτερη από την ενέργεια της συνολικής αντίδρασης. Επειδή η ελεύθερη ενέργεια Gibbs σχετίζεται με τη σταθερά ισορροπίας, K <1.
Υπάρχουν διάφοροι τρόποι για να προχωρήσετε σε δυσμενείς αντιδράσεις. Μπορείτε να παρέχετε ενέργεια θερμαίνοντας την αντίδραση, να τη συνδέσετε σε μια εξεργολογική αντίδραση ή κάνοντας την να μοιράζεται ένα ενδιάμεσο με μια ευνοϊκή αντίδραση. Μπορείτε να τραβήξετε την αντίδραση για να συνεχίσετε αφαιρώντας το προϊόν από το σύστημα.
Παραδείγματα ενεργονικών αντιδράσεων περιλαμβάνουν τη φωτοσύνθεση, την αντλία Na/K για τη σύσπαση των μυών και τη νευρική αγωγιμότητα, τη σύνθεση πρωτεϊνών και τη διάλυση χλωριούχου καλίου στο νερό.
Εξεργονικές αντιδράσεις
Μια εξεργονική αντίδραση είναι μια χημική αντίδραση με αρνητική τυπική ελεύθερη ενέργεια Gibbs, σε σταθερή θερμοκρασία και πίεση:
∆G° <0
Με άλλα λόγια, υπάρχει μια καθαρή απελευθέρωση ελεύθερης ενέργειας. Το σπάσιμο των χημικών δεσμών στα αντιδρώντα απελευθερώνει περισσότερη ενέργεια από αυτή που χρησιμοποιείται για το σχηματισμό νέων χημικών δεσμών στα προϊόντα. Οι εξεργγονικές αντιδράσεις είναι επίσης γνωστές ως εξωεργικές, ευνοϊκές ή αυθόρμητες αντιδράσεις. Όπως συμβαίνει με όλες τις αντιδράσεις, υπάρχει μια ενέργεια ενεργοποίησης που πρέπει να παρέχεται για να προχωρήσει μια εξεργολογική αντίδραση. Όμως, η ενέργεια που απελευθερώνεται από την αντίδραση είναι αρκετή για να καλύψει την ενέργεια ενεργοποίησης και να συνεχίσει την αντίδραση. Σημειώστε ότι ενώ μια εξεργονική αντίδραση είναι αυθόρμητη, μπορεί να μην προχωρήσει γρήγορα χωρίς τη βοήθεια ενός καταλύτη. Για παράδειγμα, η σκουριά του σιδήρου είναι εξεργαστική, αλλά πολύ αργή.
Παραδείγματα εξεργονικών αντιδράσεων περιλαμβάνουν την κυτταρική αναπνοή, την αποσύνθεση υπεροξειδίου του υδρογόνου και την καύση.
Endergonic/Exergonic vs Endothermic/Exothermic
Οι ενδόθερμες και οι εξώθερμες αντιδράσεις είναι τύποι ενεργονικών και εξεργονικών αντιδράσεων, αντίστοιχα. Η διαφορά είναι ότι η ενέργεια που απορροφάται από μια ενδόθερμη αντίδραση ή που απελευθερώνεται από μια εξώθερμη αντίδραση είναι θερμότητα. Ενεργονικές και εξεργονικές αντιδράσεις μπορεί να απελευθερώσουν άλλα είδη ενέργειας εκτός από τη θερμότητα, όπως το φως ή ακόμα και τον ήχο. Για παράδειγμα, ένα ραβδί λάμψης είναι μια εξεργολογική αντίδραση που απελευθερώνει φως. Δεν είναι εξώθερμη αντίδραση γιατί δεν απελευθερώνει θερμότητα.
Εμπρός και αντίστροφες αντιδράσεις
Εάν μια αντίδραση είναι ενδρογόνος προς τη μία κατεύθυνση, είναι εξεργετική προς την άλλη κατεύθυνση (και το αντίστροφο). Για αυτήν την αντίδραση, οι ενεργονικές και οι εξεργονικές αντιδράσεις μπορούν να ονομαστούν αναστρέψιμες αντιδράσεις. Η ποσότητα της ελεύθερης ενέργειας είναι η ίδια τόσο για την πρόσθια όσο και για την αντίστροφη αντίδραση, αλλά η ενέργεια απορροφάται (θετική) από την ενδρογόνο αντίδραση και απελευθερώνεται (αρνητική) από την εξεργονική αντίδραση. Για παράδειγμα, εξετάστε τη σύνθεση και την αποδόμηση της τριφωσφορικής αδενοσίνης (ATP).
Το ATP παράγεται με την ένωση ενός φωσφορικού άλατος (Pi ) στη διφωσφορική αδενοσίνη (ADP):
ADP + Pi → ATP + H2 Ο
Αυτή η αντίδραση είναι ενδρογόνος, με ΔG =+7,3 kcal/mol υπό τυπικές συνθήκες. Η αντίστροφη διαδικασία, η υδρόλυση του ATP, είναι μια εξεργολογική διαδικασία με τιμή ελεύθερης ενέργειας Gibbs ίση σε μέγεθος, αλλά αντίθετη σε πρόσημο -7,3 kcal/mol:
ATP + H2 O → ADP + Pi
Σύζευξη Ενεργονικών και Εξεργονικών Αντιδράσεων
Οι χημικές αντιδράσεις προχωρούν τόσο προς την εμπρόσθια όσο και προς την αντίστροφη κατεύθυνση έως ότου επιτευχθεί η χημική ισορροπία και οι προς τα εμπρός και αντίστροφες αντιδράσεις προχωρούν με τον ίδιο ρυθμό. Σε χημική ισορροπία, το σύστημα βρίσκεται στην πιο σταθερή ενεργειακή του κατάσταση.
Η ισορροπία είναι κακά νέα για τη βιοχημεία, επειδή τα κύτταρα χρειάζονται μεταβολικές αντιδράσεις για να συμβούν, διαφορετικά πεθαίνουν. Τα κύτταρα ελέγχουν τη συγκέντρωση των προϊόντων και των αντιδρώντων για να ευνοήσουν την κατεύθυνση της αντίδρασης που απαιτείται εκείνη τη στιγμή. Έτσι, για να δημιουργήσει ένα κύτταρο ATP, χρειάζεται να παρέχει ενέργεια και να προσθέσει ADP ή να αφαιρέσει το ATP και το νερό. Για να συνεχιστεί η μετατροπή του ATP σε ενέργεια, το κύτταρο παρέχει αντιδρώντα ή αφαιρεί προϊόντα.
Συχνά, μια χημική αντίδραση τροφοδοτεί την επόμενη και οι ενεργονικές αντιδράσεις συνδέονται με εξεργογικές αντιδράσεις για να τους δώσουν αρκετή ενέργεια για να προχωρήσουν. Για παράδειγμα, η βιοφωταύγεια πυγολαμπίδας προκύπτει από την ενδρογόνο φωταύγεια από τη λουσιφερίνη, σε συνδυασμό με την εξεργολογική απελευθέρωση ATP.
Αναφορές
- Hamori, Eugene (2002). «Χτίζοντας τα θεμέλια για τη βιοενέργεια». Εκπαίδευση Βιοχημείας και Μοριακής Βιολογίας . 30 (5):296-302. doi:10.1002/bmb.2002.494030050124
- Hamori, Eugene; James E. Muldrey (1984). «Χρήση της λέξης «πρόθυμος» αντί του «αυθόρμητου» για την περιγραφή εξεργονικών αντιδράσεων». Journal of Chemical Education . 61 (8):710. doi:10.1021/ed061p710
- IUPAC (1997). Σύνοψη Χημικής Ορολογίας (2η έκδ.) (το «Χρυσό Βιβλίο»). ISBN 0-9678550-9-8. doi:10.1351/goldbook




