Ατομική ακτίνα και ιοντική ακτίνα

Το μέγεθος ενός ατόμου δεν είναι μια εύκολη ιδιότητα να μετρηθεί, επειδή τα άτομα είναι πολύ μικρά και το ηλεκτρονιακό τους κέλυφος είναι περισσότερο σύννεφο παρά σφαιρικό κέλυφος. Η ατομική ακτίνα και η ιοντική ακτίνα είναι δύο από τις πιο κοινές μετρήσεις μεγέθους ατόμου. Ακολουθούν οι ορισμοί της ατομικής και ιοντικής ακτίνας, η διαφορά μεταξύ τους και η τάση τους στον περιοδικό πίνακα.
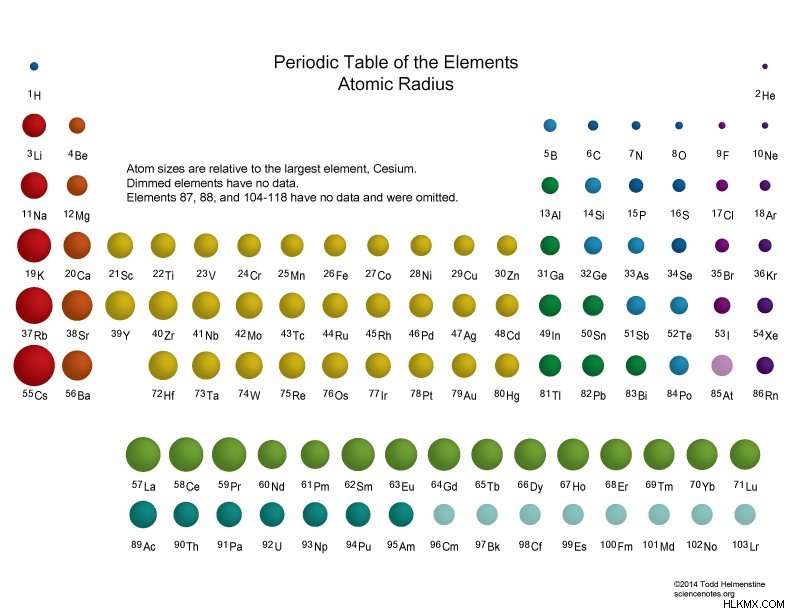
Ατομική ακτίνα
Η ατομική ακτίνα είναι η μέση απόσταση από το κέντρο του πυρήνα ενός ουδέτερου ατόμου μέχρι το εξωτερικό όριο του ηλεκτρονιακού κελύφους του. Για μεμονωμένα ουδέτερα άτομα, ο ατομικός πυρήνας κυμαίνεται από 30 πικόμετρα (τρισεκατομμυριοστά του μέτρου) και 300 pm. Το μεγαλύτερο άτομο είναι το καίσιο, ενώ το μικρότερο άτομο είναι το ήλιο. Το μεγαλύτερο μέρος του μεγέθους ενός ατόμου προέρχεται από τα ηλεκτρόνια του. Η ατομική ακτίνα είναι πάνω από 10.000 φορές μεγαλύτερη από την ακτίνα του ατομικού πυρήνα (1 έως 10 femtometers). Για να το θέσουμε διαφορετικά, η ατομική ακτίνα είναι μικρότερη από το ένα χιλιοστό του μήκους κύματος του ορατού φωτός (400 έως 700 nm).
Το άκρο του κελύφους ηλεκτρονίων δεν είναι καλά καθορισμένο, επομένως θα βρείτε διαφορετικές τιμές για κάθε άτομο, ανάλογα με την αναφορά. Ωστόσο, οι πραγματικοί αριθμοί δεν είναι τόσο σημαντικοί όσο τα σχετικά μεγέθη των ατόμων.
Ιονική ακτίνα
Ενώ η ατομική ακτίνα μετρά το μέγεθος ενός ουδέτερου ατόμου, η ιονική ακτίνα μετράει το μέγεθος ενός ηλεκτρικά φορτισμένου ατόμου. Η ιοντική ακτίνα είναι η ακτίνα ενός μονοατομικού ιόντος ενός στοιχείου εντός ενός ιοντικού κρυστάλλου ή η μισή απόσταση μεταξύ δύο συνδεδεμένων ατόμων αερίου. Οι τιμές ιοντικής ακτίνας κυμαίνονται από 31 μ.μ. έως πάνω από 200 μ.μ.
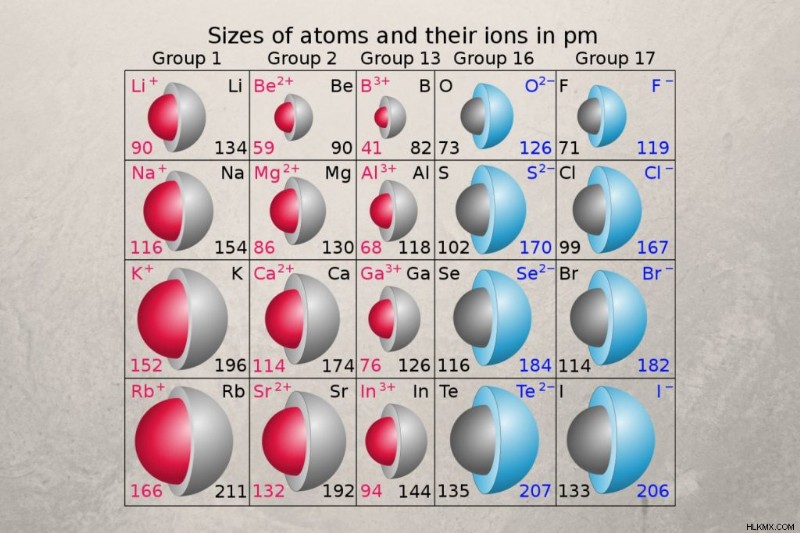
Η ιοντική ακτίνα δεν είναι μια σταθερή ιδιότητα, επομένως η τιμή για ένα ιόν ενός στοιχείου εξαρτάται από τις συνθήκες. Ο αριθμός συντονισμού και η κατάσταση σπιν είναι οι κύριοι παράγοντες που επηρεάζουν τις μετρήσεις της ιοντικής ακτίνας. Η κρυσταλλογραφία ακτίνων Χ δίνει εμπειρικές μετρήσεις ιοντικής ακτίνας. Ο Pauling χρησιμοποίησε αποτελεσματικό πυρηνικό φορτίο για να υπολογίσει την ιοντική ακτίνα. Οι πίνακες ιοντικών ακτίνων συνήθως υποδεικνύουν τη μέθοδο που χρησιμοποιείται για τον προσδιορισμό των τιμών.
Τάση περιοδικού πίνακα
Η διαμόρφωση ηλεκτρονίων καθορίζει την οργάνωση των στοιχείων στον περιοδικό πίνακα, επομένως η ατομική και η ιοντική ακτίνα εμφανίζουν περιοδικότητα:
- Η ατομική και η ιοντική ακτίνα αυξάνονται κινούμενοι προς τα κάτω σε μια ομάδα ή στήλη του περιοδικού πίνακα. Αυτό συμβαίνει επειδή τα άτομα αποκτούν ένα κέλυφος ηλεκτρονίων.
- Η ατομική και η ιοντική ακτίνα γενικά μειώνονται κινούμενοι σε μια περίοδο ή μια γραμμή του περιοδικού πίνακα. Αυτό συμβαίνει επειδή ο αυξανόμενος αριθμός πρωτονίων ασκεί ισχυρότερη έλξη στα ηλεκτρόνια, έλκοντάς τα πιο σφιχτά. Τα ευγενή αέρια αποτελούν εξαίρεση σε αυτή την τάση. Το μέγεθος του ατόμου ευγενούς αερίου είναι μεγαλύτερο από το άτομο αλογόνου που προηγείται.
Ατομική ακτίνα έναντι ιονικής ακτίνας
Η ατομική ακτίνα και η ιοντική ακτίνα ακολουθούν την ίδια τάση στον περιοδικό πίνακα. Όμως, η ιοντική ακτίνα μπορεί να είναι είτε μεγαλύτερη είτε μικρότερη από την ατομική ακτίνα ενός στοιχείου, ανάλογα με το ηλεκτρικό φορτίο. Η ιοντική ακτίνα αυξάνεται με αρνητικό φορτίο και μειώνεται με θετικό φορτίο.
- Κατιόν ή θετικό ιόν :Ένα άτομο χάνει ένα ή περισσότερα ηλεκτρόνια όταν σχηματίζει κατιόν, καθιστώντας το ιόν μικρότερο από το ουδέτερο άτομο. Τα μέταλλα συνήθως σχηματίζουν κατιόντα, επομένως η ιοντική τους ακτίνα τείνει να είναι μικρότερη από την ατομική τους ακτίνα.
- Ανιόν ή αρνητικό ιόν :Ένα άτομο αποκτά ένα ή περισσότερα ηλεκτρόνια για να σχηματίσει ένα ανιόν, καθιστώντας το ιόν μεγαλύτερο από το ουδέτερο άτομο. Τα αμέταλλα συχνά σχηματίζουν ανιόντα, επομένως η ιοντική τους ακτίνα τείνει να είναι μεγαλύτερη από την ατομική τους ακτίνα. Αυτό είναι ιδιαίτερα αισθητό για τα αλογόνα.
Ερωτήσεις Εργασίας Ατομικής και Ιονικής Ακτίνας
Συχνά ζητείται από τους μαθητές να παραγγείλουν το μέγεθος των ατόμων και των ιόντων με βάση τη διαφορά μεταξύ ατομικής και ιοντικής ακτίνας και των τάσεων του περιοδικού πίνακα.
Για παράδειγμα:Καταγράψτε τα είδη με σειρά αυξανόμενου μεγέθους:Rb, Rb, F, F, Te
Δεν χρειάζεται να γνωρίζετε τα μεγέθη των ατόμων και των ιόντων για να τα παραγγείλετε. Γνωρίζετε ότι το κατιόν του ρουβιδίου είναι μικρότερο από το άτομο του ρουβιδίου επειδή έπρεπε να χάσει ένα ηλεκτρόνιο για να σχηματίσει το ιόν. Ταυτόχρονα, ξέρετε ότι το ρουβίδιο έχασε ένα κέλυφος ηλεκτρονίων όταν έχασε ένα ηλεκτρόνιο. Γνωρίζετε ότι το ανιόν του φθορίου είναι μεγαλύτερο από το άτομο του φθορίου επειδή απέκτησε ένα ηλεκτρόνιο για να σχηματίσει το ιόν.
Στη συνέχεια, κοιτάξτε τον περιοδικό πίνακα για να προσδιορίσετε το σχετικό μέγεθος των ατόμων των στοιχείων. Ένα ουδέτερο τελλούριο είναι μικρότερο από ένα ουδέτερο άτομο ρουβιδίου επειδή η ατομική ακτίνα μειώνεται καθώς κινείστε σε μια περίοδο. Ωστόσο, το άτομο του τελλουρίου είναι μεγαλύτερο από το κατιόν του ρουβιδίου επειδή έχει ένα επιπλέον κέλυφος ηλεκτρονίων.
Συνδυάζοντας τα όλα μαζί:
F
Η ατομική και η ιοντική ακτίνα δεν είναι οι μόνοι τρόποι μέτρησης του μεγέθους των ατόμων και των ιόντων. Η ομοιοπολική ακτίνα, η ακτίνα van der Waals, η μεταλλική ακτίνα και η ακτίνα Bohr είναι πιο κατάλληλες σε ορισμένες περιπτώσεις. Αυτό συμβαίνει επειδή το μέγεθος ενός ατόμου επηρεάζεται από τη συμπεριφορά του χημικού δεσμού του.
Τα ισοηλεκτρονικά ιόντα είναι κατιόντα ή ανιόντα διαφορετικών στοιχείων που έχουν την ίδια ηλεκτρονική δομή και τον ίδιο αριθμό ηλεκτρονίων σθένους. Για παράδειγμα, το K και το Ca έχουν και τα δύο τη διαμόρφωση ηλεκτρονίων [Ne]4s. Τα S και P έχουν και τα δύο 1s 2s 2p 3s 3p ως διαμόρφωση ηλεκτρονίων τους. Η ισοηλεκτρονικότητα μπορεί να χρησιμοποιηθεί για τη σύγκριση ιοντικών ακτίνων διαφορετικών στοιχείων και για την πρόβλεψη των ιδιοτήτων τους με βάση τη συμπεριφορά των ηλεκτρονίων τους.Άλλες μετρήσεις ατομικής ακτίνας
Ισοηλεκτρονικά ιόντα
Αναφορές