Τι είναι ένα μόριο; Ορισμός και Παραδείγματα
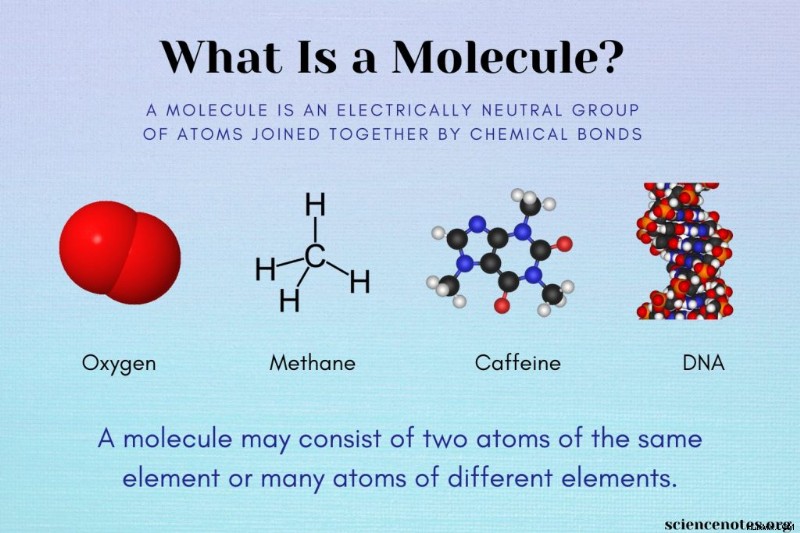
Ένα μόριο ορίζεται ως μια ηλεκτρικά ουδέτερη ομάδα δύο ή περισσότερων ατόμων που συνδέονται με χημικούς δεσμούς. Ακολουθούν παραδείγματα μορίων και μια ματιά στη διαφορά μεταξύ μορίων, ενώσεων και ιόντων.
Atom vs Molecule
Ένα άτομο είναι η μικρότερη μονάδα ενός στοιχείου. Όλα τα άτομα ενός μόνο στοιχείου περιέχουν τον ίδιο αριθμό πρωτονίων. Τα άτομα δεν μπορούν να διαιρεθούν περαιτέρω χρησιμοποιώντας καμία χημική μέθοδο. Αντίθετα, ένα μόριο είναι η μονάδα μιας καθαρής ουσίας. Ένα μόριο αποτελείται από περισσότερα από ένα άτομα. Ένα δεδομένο μόριο έχει σταθερή σύνθεση, που σημαίνει ότι η αναλογία διαφορετικών ατόμων είναι πάντα η ίδια. Τα ίδια μόρια εμφανίζουν επίσης τις ίδιες χημικές ιδιότητες. Σε αντίθεση με τα άτομα, τα μόρια μπορεί να σπάσουν από χημικές αντιδράσεις. Το σπάσιμο όλων των χημικών δεσμών σε ένα μόριο έχει ως αποτέλεσμα μια συλλογή ατόμων.
Παραδείγματα μορίων
Ένα μόριο μπορεί να αποτελείται από δύο ή περισσότερα άτομα ενός μόνο στοιχείου ή άτομα διαφορετικών στοιχείων. Ακολουθούν μερικά παραδείγματα μορίων:
- H2 O (νερό)
- Ν2 (άζωτο)
- O3 (όζον)
- CaO (οξείδιο του ασβεστίου)
- CO2 (διοξείδιο του άνθρακα)
- C6 H12 O6 (γλυκόζη, είδος ζάχαρης)
- NaCl (επιτραπέζιο αλάτι)
- Αιμοσφαιρίνη (C738 H1166 N812 O203_S2 Fe)
- Βιταμίνη C ή ασκορβικό οξύ (C6 H8 O6 )
- Δεοξυριβονουκλεϊκό οξύ (DNA)
Τύποι μορίων
Τα μόρια ταξινομούνται ανάλογα με τη σύνθεσή τους:
- Διατομικό μόριο – Ένα διατομικό μόριο αποτελείται από δύο μόνο άτομα. Αυτά μπορεί να είναι άτομα ενός μόνο στοιχείου (ομοπυρηνικά) ή άτομα διαφορετικών στοιχείων (ετεροπυρηνικά). O2 είναι ένα παράδειγμα ομοπυρηνικού διατομικού μορίου. Το HCl είναι ένα παράδειγμα ετεροπυρηνικού διατομικού μορίου.
- Πολυατομικό μόριο – Ένα πολυατομικό μόριο αποτελείται από περισσότερα από δύο άτομα. Γλυκόζη (C6 H12 O6 ) και νερό (H2 O) είναι παραδείγματα πολυατομικών μορίων.
- Μακρομόριο – Ένα μακρομόριο είναι ένα πολύ μεγάλο μόριο, που συχνά αποτελείται από υπομονάδες. Οι πρωτεΐνες και το DNA είναι παραδείγματα μακρομορίων.
Ένας άλλος τρόπος ταξινόμησης των μορίων είναι με βάση τους χημικούς δεσμούς τους.
- Ομοιοπολικό μόριο – Τα ομοιοπολικά μόρια αποτελούνται από άτομα που συνδέονται με ομοιοπολικούς χημικούς δεσμούς. Τα ομοιοπολικά μόρια αποτελούνται από νομέταλλα. Σε ένα καθαρό ομοιοπολικό μόριο, τα άτομα έχουν τις ίδιες τιμές ηλεκτραρνητικότητας. Παραδείγματα καθαρών ομοιοπολικών μορίων είναι το H2 και O3 . Στα πολικά ομοιοπολικά μόρια, τα άτομα έχουν ελαφρώς διαφορετικές τιμές ηλεκτραρνητικότητας. Παραδείγματα πολικών ομοιοπολικών μορίων είναι το νερό (H2 Ο) και υδροχλωρικό οξύ (HCl).
- Ιονικό μόριο – Τα ιοντικά μόρια αποτελούνται τόσο από μέταλλα όσο και από αμέταλλα (με λίγες εξαιρέσεις). Το κατιόν (πρώτο μέρος του μορίου) και το ανιόν (δεύτερο μέρος του μορίου) έχουν πολύ διαφορετικές τιμές ηλεκτραρνητικότητας. Τα ιοντικά μόρια εμφανίζουν ακραία πολικότητα, αλλά συνήθως όταν κάποιος μιλά για ένα πολικό μόριο, εννοεί ένα πολικό ομοιοπολικό μόριο. Παραδείγματα ιοντικών μορίων περιλαμβάνουν αλάτι (NaCl), οξικό αμμώνιο (NH4 CH3 CO2 – μια ιοντική ένωση που αποτελείται μόνο από αμέταλλα) και υδροξείδιο του νατρίου (NaOH).
Διαφορά μεταξύ ενός μορίου και μιας ένωσης
Μια ένωση αποτελείται από δύο ή περισσότερα διαφορετικά στοιχεία που ενώνονται με χημικούς δεσμούς. νερό (H2 Το Ο) και το υδροχλωρικό οξύ (HCl) είναι ενώσεις. Αέριο υδρογόνο (H2 ) και το όζον (O3 ) είναι μόρια, αλλά όχι ενώσεις. Όλες οι ενώσεις είναι μόρια, αλλά δεν είναι όλα τα μόρια ενώσεις.
Διαφορά μεταξύ ενός μορίου και ενός ιόντος
Ένα μόριο είναι ηλεκτρικά ουδέτερο. Ο συνολικός αριθμός πρωτονίων και ηλεκτρονίων είναι ο ίδιος. Ένα ιόν περιέχει διαφορετικό αριθμό πρωτονίων και ηλεκτρονίων. Εάν υπάρχουν περισσότερα πρωτόνια, το ιόν φέρει θετικό φορτίο. Εάν υπάρχουν περισσότερα ηλεκτρόνια, το ιόν φέρει αρνητικό φορτίο. Ένα ιόν μπορεί να ξεκινήσει ως άτομο (Ο) ή μόριο (H3 Ο). Μπορείτε να το ξεχωρίσετε από ένα μόριο επειδή έχει πάντα ένα + ή - εκθέτη για τη φόρτισή του.
Τι είναι Δεν ένα Μόριο;
Παραδείγματα ουσιών που δεν είναι μόρια είναι τα άτομα και τα ιόντα:
- H (άτομο υδρογόνου)
- Ag (άτομο αργύρου)
- PO4 (φωσφορικό ιόν)
Επιπλέον, τα κράματα δεν είναι ακριβώς μόρια ή ενώσεις. Αυτό συμβαίνει επειδή ένα κράμα αποτελείται από ένα μείγμα μετάλλων και μη μετάλλων. Τα στοιχεία μπορεί να σχηματίζουν κάποιους χημικούς δεσμούς, αλλά δεν συνδέονται σε μια σταθερή μοριακή αναλογία.
Αναφορές
- Brown, T.L.; Kenneth C. Kemp; Theodore L. Brown; Harold Eugene LeMay; Bruce Edward Bursten (2003). Χημεία – Η Κεντρική Επιστήμη (9η έκδ.). New Jersey:Prentice Hall. ISBN 978-0-13-066997-1.
- Chang, Raymond (1998). Χημεία (6η έκδ.). Νέα Υόρκη:McGraw Hill. ISBN 978-0-07-115221-1.
- IUPAC (1997). "Μόριο." Σύνοψη Χημικής Ορολογίας (2η έκδ.) (το «Χρυσό Βιβλίο»). Oxford:Blackwell Scientific Publications. ISBN 0-9678550-9-8. doi:10.1351/goldbook
- Zumdahl, Steven S. (1997). Χημεία (4η έκδ.). Βοστώνη:Houghton Mifflin. ISBN 978-0-669-41794-4.