Τρόπος Υπολογισμού Θεωρητικής Απόδοσης – Ορισμός και Παράδειγμα

Ηθεωρητική απόδοση μιας χημικής αντίδρασης είναι η ποσότητα του προϊόντος που παίρνετε εάν τα αντιδρώντα αντιδρούν πλήρως. Ακολουθούν τα βήματα για τον υπολογισμό της θεωρητικής απόδοσης, μαζί με ένα επεξεργασμένο παράδειγμα προβλήματος.
Βήματα για τον υπολογισμό της θεωρητικής απόδοσης
- Γράψτε την ισορροπημένη χημική εξίσωση για την αντίδραση.
- Προσδιορίστε το περιοριστικό αντιδραστήριο.
- Μετατρέψτε τα γραμμάρια περιοριστικού αντιδραστηρίου σε mole.
- Χρησιμοποιήστε τη μοριακή αναλογία μεταξύ του περιοριστικού αντιδραστηρίου και του προϊόντος και βρείτε τον θεωρητικό αριθμό γραμμομορίων του προϊόντος.
- Μετατρέψτε τον αριθμό των mole του προϊόντος σε γραμμάρια.
Μερικές φορές θα γνωρίζετε μερικά από αυτά τα βήματα χωρίς να χρειάζεται να τα καταλάβετε. Για παράδειγμα, μπορεί να γνωρίζετε την ισορροπημένη εξίσωση ή να σας δοθεί το περιοριστικό αντιδραστήριο. Για παράδειγμα, όταν ένα αντιδρών είναι «σε περίσσεια», ξέρετε ότι το άλλο (αν υπάρχουν μόνο δύο αντιδραστήρια) είναι το περιοριστικό αντιδραστήριο.
Πρόβλημα παραδείγματος θεωρητικής απόδοσης
Ας δούμε την ακόλουθη αντίδραση όπου θερμαίνεται το χλωρικό κάλιο (KClO3 ) παράγει αέριο οξυγόνο (O2 ) και χλωριούχο κάλιο (KCl).
2 KClO3 (s) → 3 O2 (ζ) + 2 KCl (s)
Αυτή η αντίδραση είναι αρκετά συχνή στα σχολικά εργαστήρια, καθώς είναι μια σχετικά φθηνή μέθοδος λήψης αερίου οξυγόνου.
Η ισορροπημένη αντίδραση δείχνει ότι 2 moles KClO3 παράγουν 3 moles O2 και 2 mol KCl. Για να υπολογίσετε τη θεωρητική απόδοση, χρησιμοποιείτε αυτούς τους λόγους ως συντελεστή μετατροπής. Ακολουθεί ένα τυπικό παράδειγμα προβλήματος.
Ερώτηση: Πόσα mol αερίου οξυγόνου θα παραχθούν από τη θέρμανση 735,3 γραμμαρίων KClO3 ?
Το πρόβλημα δίνει την ισορροπημένη εξίσωση και προσδιορίζει το περιοριστικό αντιδραστήριο (σε αυτή την περίπτωση, το μόνο αντιδραστήριο), οπότε τώρα πρέπει να γνωρίζουμε τον αριθμό των γραμμομορίων KClO3 . Κάντε αυτό μετατρέποντας γραμμάρια KClO3 σε κρεατοελιές KClO3 . Για να το κάνετε αυτό πιο εύκολο, γνωρίζετε τη μοριακή μάζα του KClO3 είναι 122,55 g/mol.
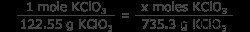
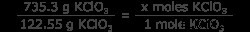
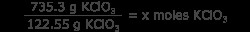
6 =x moles KClO3
Χρησιμοποιήστε τη χημική εξίσωση για να συσχετίσετε τα mol KClO3 σε κρεατοελιές O2 . Αυτή είναι η μοριακή αναλογία μεταξύ των δύο ενώσεων. Βλέπουμε 2 moles KClO3 παράγει 3 moles O2 αέριο. Χρησιμοποιήστε τη μοριακή αναλογία και βρείτε τον αριθμό των γραμμομορίων οξυγόνου που σχηματίζονται από 6 γραμμομόρια χλωρικού καλίου.
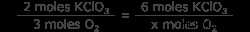
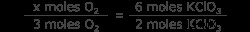

x moles O2 =3 x 3 moles O2
x moles O2 =9 moles O2
6 moles KClO3 (735,3 γραμμάρια KClO3 ) παράγουν 9 moles O2 αέριο.
Τεχνικά, αυτή είναι η θεωρητική απόδοση, αλλά η απάντηση γίνεται πιο χρήσιμη όταν μετατρέπετε τα mole σε γραμμάρια. Χρησιμοποιήστε την ατομική μάζα του οξυγόνου και τον μοριακό τύπο για τη μετατροπή. Από τον περιοδικό πίνακα, η ατομική μάζα του οξυγόνου είναι 16,00. Υπάρχουν δύο άτομα οξυγόνου σε κάθε O2 μόριο.
x γραμμάρια O2 =(2)(16,00 γραμμάρια O2 /ΕΛΙΑ δερματος)
x γραμμάρια O2 =32 g/mol
Τέλος, η θεωρητική απόδοση είναι ο αριθμός των γραμμομορίων αερίου οξυγόνου πολλαπλασιασμένος με τον συντελεστή μετατροπής mole σε γραμμάρια:
θεωρητική απόδοση του O2 =(9 moles) (32 γραμμάρια/mole)
θεωρητική απόδοση του O2 =288 γραμμάρια
Υπολογισμός αντιδραστηρίου που απαιτείται για τη δημιουργία προϊόντος
Μια παραλλαγή του υπολογισμού της θεωρητικής απόδοσης σάς βοηθά να βρείτε πόση ποσότητα αντιδραστηρίου χρησιμοποιείτε όταν θέλετε μια προκαθορισμένη ποσότητα προϊόντος. Εδώ πάλι, ξεκινήστε με την ισορροπημένη εξίσωση και χρησιμοποιήστε τη μοριακή αναλογία μεταξύ αντιδρώντος και προϊόντος.
Ερώτηση: Πόσα γραμμάρια αερίου υδρογόνου και αερίου οξυγόνου χρειάζονται για να παραχθούν 90 γραμμάρια νερού;
Βήμα 1:Γράψτε την ισορροπημένη εξίσωση.
Ξεκινήστε με την μη ισορροπημένη εξίσωση. Το αέριο υδρογόνο και το αέριο οξυγόνο αντιδρούν, παράγοντας νερό:
H2 (ζ) + O2 (ζ) → H2 O(l)
Η εξισορρόπηση της εξίσωσης αποδίδει τις μοριακές αναλογίες:
2 H2 (ζ) + O2 (ζ) → 2 H2 O(l)
Βήμα 2:Προσδιορίστε το περιοριστικό αντιδραστήριο.
Λοιπόν, σε αυτήν την περίπτωση, η ποσότητα του προϊόντος (νερό) είναι το όριό σας επειδή εργάζεστε την αντίδραση προς τα πίσω.
Βήμα 3:Μετατρέψτε τα γραμμάρια περιοριστικού αντιδραστηρίου σε mole.
κρεατοελιές H2 O =(90 γραμμάρια H2 Ο)(1 mole H2 O/18,00 γραμμάρια H2 Ο)
κρεατοελιές H2 O =5 moles
Βήμα 4:Χρησιμοποιήστε την αναλογία mole.
Από την ισορροπημένη εξίσωση, υπάρχει μια σχέση γραμμομορίων 1:1 μεταξύ του αριθμού των mol του H2 και H2 Ο. Άρα, 5 moles νερού προέρχονται από την αντίδραση 5 moles υδρογόνου.
Ωστόσο, υπάρχει μια αναλογία 1:2 μεταξύ των γραμμομορίων του O2 και H2 Ο. Χρειάζεστε το μισό αριθμό γραμμομορίων αερίου οξυγόνου σε σύγκριση με τον αριθμό γραμμομορίων νερού.
κρεατοελιές O2 =(γραμμομοριακή αναλογία) (moles νερό)
κρεατοελιές O2 =(1 mol O2 /2 mol H2 Ο) (5 mol H2 Ο)
κρεατοελιές O2 =2,5 mol
Βήμα 5:Μετατροπή κρεατοελιών σε γραμμάρια.
γραμμάρια H2 =(moles H2 )(2 g H2 /1 mol H2 )
γραμμάρια H2 =(5 moles H2 )(2 g H2 /1 mol H2 )
γραμμάρια H2 =(5 moles H2 )(2 g H2 /1 mol H2 )
γραμμάρια H2 =10 γραμμάρια
γραμμάρια O2 =(moles O2 )(32 g O2 /1 mol O2 )
γραμμάρια O2 =(2,5 mol O2 )(32 g O2 /1 mol O2 )
γραμμάρια O2 =80 γραμμάρια
Έτσι, χρειάζεστε 10 γραμμάρια αερίου υδρογόνου και 80 γραμμάρια αερίου οξυγόνου για να φτιάξετε 90 γραμμάρια νερού.
Αναφορές
- Petrucci, R.H., Harwood, W.S.; Ρέγγα, F.G. (2002) General Chemistry (8η έκδ.). Prentice Hall. ISBN 0130143294.
- Vogel, A. I.; Tatchell, Α. R.; Furnis, Β. S.; Hannaford, Α. J.; Smith, P. W. G. (1996) Vogel's Textbook of Practical Organic Chemistry (5η έκδ.). Pearson. ISBN 978-0582462366.
- Whitten, K.W., Gailey, K.D; Davis, R.E. (1992) General Chemistry (4η έκδ.). Saunders College Publishing. ISBN 0030723736.