Το ισχυρότερο οξύ του κόσμου - Τα υπεροξέα
Το ισχυρότερο οξύ στον κόσμο είναι το φθοριοαντιμονικό οξύ, ένα από τα υπεροξέα. Τα υπεροξέα είναι τόσο ισχυρά που δεν μετρώνται καν χρησιμοποιώντας το κανονικό pH ή pKA Ζυγός. Ακολουθεί μια ματιά στο φθοροαντιμονικό οξύ και άλλα υπεροξέα και πώς λειτουργούν.
Τι είναι τα υπεροξέα;
Ένα υπεροξύ είναι ένα ισχυρό οξύ με οξύτητα μεγαλύτερη από αυτή του καθαρού θειικού οξέος. Οι χημικοί περιγράφουν την ισχύ υπεροξέων χρησιμοποιώντας τη συνάρτηση οξύτητας Hammett (H0 ) ή άλλες ειδικές συναρτήσεις οξύτητας επειδή η κλίμακα pH ισχύει μόνο για αραιά υδατικά διαλύματα.
Πώς λειτουργούν τα υπεροξέα
Πολλά υπεροξέα σχηματίζονται με την ανάμειξη ενός οξέος Brønsted και ενός οξέος Lewis. Το οξύ Lewis δεσμεύει και σταθεροποιεί το ανιόν που σχηματίζεται με διάσταση του οξέος Brønsted. Αυτό αφαιρεί έναν δέκτη πρωτονίων, καθιστώντας το οξύ καλύτερο δότη πρωτονίων.
Μπορεί να ακούσετε ότι τα υπεροξέα έχουν «γυμνά» ή «αδέσμευτα» πρωτόνια, αλλά αυτό δεν είναι αλήθεια. Το οξύ δίνει πρωτόνια σε ουσίες που κανονικά δεν τα δέχονται, αλλά αρχικά τα πρωτόνια συνδέονται με μόρια του οξέος και δεν επιπλέουν ελεύθερα. Ωστόσο, αυτά τα πρωτόνια κινούνται γρήγορα μεταξύ ενός δέκτη πρωτονίων και του επόμενου. Αυτό που συμβαίνει είναι ότι το υπεροξύ είναι ένας εξαιρετικά φτωχός δέκτης πρωτονίων. Έτσι, είναι πιο εύκολο για ένα πρωτόνιο να προσκολληθεί στην άλλη ουσία παρά να επιστρέψει στο οξύ.
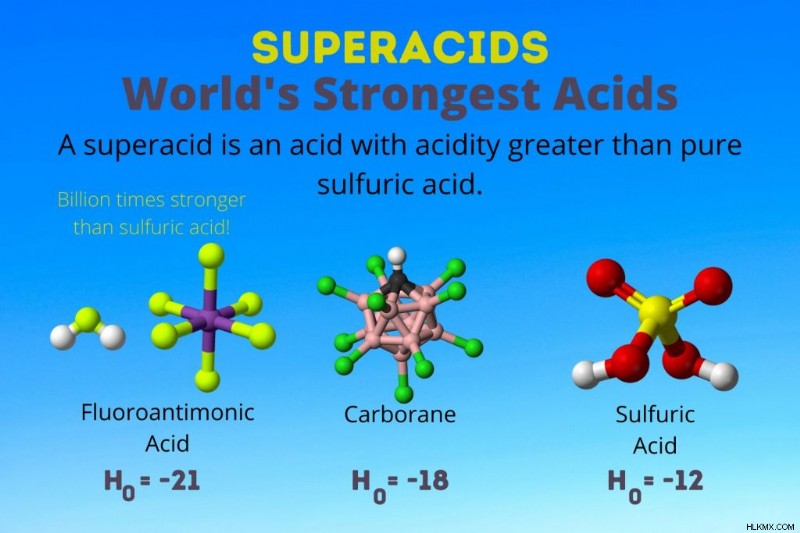
Το ισχυρότερο οξύ στον κόσμο
Το ισχυρότερο οξύ στον κόσμο είναι το υπεροξύ που ονομάζεται φθοριοαντιμονικό οξύ (HSbF6 ). Είναι πάνω από ένα δισεκατομμύριο φορές ισχυρότερο από το καθαρό θειικό οξύ. Με άλλα λόγια, το φθοροαντιμονικό οξύ δίνει πρωτόνια περίπου ένα δισεκατομμύριο φορές καλύτερα από το θειικό οξύ.
Ανάμιξη ίσων ποσοτήτων υδροφθορίου (HF) και πενταφθοριούχου αντιμονίου (HSbF6 ) κάνει το πιο ισχυρό φθοροαντιμονικό οξύ, αλλά και άλλα μείγματα παράγουν ένα υπεροξύ.
HF + SbF5 → H SbF6
Το φθοριοαντιμονικό οξύ είναι δυσάρεστο πράγμα. Είναι πολύ διαβρωτικό και απελευθερώνει τοξικούς ατμούς. Αποσυντίθεται εκρηκτικά στο νερό, επομένως βρίσκει χρήση μόνο σε διαλύματα υδροφθορικού οξέος. Το φθοροαντιμονικό οξύ διασπάται με τη θερμότητα για να απελευθερώσει αέριο υδροφθόριο. Το οξύ πρωτονιώνει το γυαλί, τα περισσότερα πλαστικά και τον ανθρώπινο ιστό.
Τα καρβορανικά οξέα
Το φθοροαντιμονικό οξύ προκύπτει από ένα μείγμα οξέων, αλλά τα καρβορανικά οξέα [π.χ., H(CHB11 Cl11 )] είναι σόλο οξέα. Το H0 από τα καρβορανικά οξέα είναι τουλάχιστον -18, αλλά η φύση του μορίου του οξέος καθιστά δύσκολο τον υπολογισμό της ισχύος του. Τα καρβορανικά οξέα μπορεί να είναι ακόμη ισχυρότερα από το φθοροαντιμονικό οξύ. Είναι τα μόνα οξέα ικανά να πρωτονιώσουν το C60 και διοξείδιο του άνθρακα. Παρά την αντοχή τους, τα καρβορανικά οξέα δεν είναι διαβρωτικά. Δεν καίνε το δέρμα και μπορούν να αποθηκευτούν σε συνηθισμένα δοχεία.
Κατάλογος υπεροξέων
Τα υπεροξέα έχουν οξύτητα μεγαλύτερη από το θειικό οξύ, το οποίο έχει δραστηριότητα Hammett -11,9 (H0 =-11,9). Άρα, τα υπεροξέα έχουν H0 <-12. Το pH του 12Μ θειικού οξέος είναι αρνητικό χρησιμοποιώντας την εξίσωση Henderson-Hasselbalch. Ενώ η εξίσωση χρησιμοποιεί υποθέσεις που δεν ισχύουν για τα υπεροξέα, θα μπορούσαμε να πούμε ότι όλα τα υπεροξέα έχουν αρνητικές τιμές pH.
| Όνομα | Τύπος | H0 |
| Φθοροαντιμονικό οξύ | HF:SbF5 | Μεταξύ -21 και -23 |
| Μαγικό οξύ | HSO3 F:SbF5 | -19.2 |
| Καρβορανικά οξέα | H(HCB11 X11 ) | περίπου -18 |
| Φθοροβορικό οξύ | HF:BF3 | -16,6 |
| Φθοροθειικό οξύ | FSO3 H | -15.1 |
| Υδροφθόριο | HF | -15.1 |
| Τριφθορομεθανοσουλφονικό οξύ (Τριφλικό οξύ) | CF3 SO3 H | -14,9 |
| Περχλωρικό οξύ | HClO4 | -13 |
| Θειικό οξύ | H2 SO4 | -11,9 |
Πώς αποθηκεύονται τα υπεροξέα;
Δεν υπάρχει υλικό δοχείου που να ταιριάζει σε όλα για τα υπεροξέα. Είναι ασφαλές να αποθηκεύετε καρβορανικά οξέα σε γυαλί. Το φθοριοθειικό οξύ και το φθοριοαντιμονικό οξύ τρώνε μέσα από το γυαλί και το κανονικό πλαστικό. Απαιτούν δοχεία πολυτετραφθοροαιθυλενίου (τεφλόν). Ο συνδυασμός άνθρακα με φθόριο προστατεύει από την επίθεση με οξύ.
Χρήσεις των ισχυρότερων οξέων
Γιατί κάποιος να χρησιμοποιήσει ένα τόσο ισχυρό οξύ, πολύ λιγότερο ένα τόσο τοξικό και διαβρωτικό όσο το φθοριοαντιμονικό οξύ; Αυτά τα οξέα δεν χρησιμοποιούνται στην καθημερινή ζωή ή ακόμα και σε ένα κανονικό εργαστήριο χημείας. Αντίθετα, βρίσκουν χρήση στην οργανική χημεία και τη χημική μηχανική για να πρωτονιώσουν ενώσεις που κανονικά δεν δέχονται πρωτόνια. Επίσης, είναι χρήσιμα επειδή λειτουργούν σε διαλύτες εκτός από νερό.
Τα υπεροξέα είναι καταλύτες στην πετροχημεία. Στερεές μορφές οξέων αλκυλιώνουν το βενζόλιο με προπένιο και αιθένιο και ακυλικό χλωροβενζόλιο. Αντιδράσεις όπως αυτή βοηθούν στην παραγωγή βενζίνης υψηλών οκτανίων και στη σύνθεση πλαστικών. Τα υπεροξέα χρησιμοποιούνται για την κατασκευή εκρηκτικών, την παραγωγή αιθέρων και ολεφινών, την χάραξη γυαλιού, τον ισομερισμό υδρογονανθράκων και τη σταθεροποίηση των καρβοκατιόντων.
Αναφορές
- Ghosh, Abhik; Berg, Steffen (2014). Βέλος ώθηση στην ανόργανη χημεία:Μια λογική προσέγγιση στη χημεία των στοιχείων της κύριας ομάδας . Wiley.
- Hall, N.F.; Conant, J.B. (1927). «Μια μελέτη διαλυμάτων υπεροξέων». Journal of the American Chemical Society . 49 (12):3047-3061. doi:10.1021/ja01411a010
- Hammett, L. P. (1940). Φυσική Οργανική Χημεία . Νέα Υόρκη:McGraw-Hill.
- Herlem, Michel (1977). «Είναι αντιδράσεις σε υπερόξινα μέσα που οφείλονται σε πρωτόνια ή σε ισχυρά οξειδωτικά είδη όπως το SO3 ή SbF5;». Καθαρή και Εφαρμοσμένη Χημεία . 49:107–113. doi:10.1351/pac197749010107




