Διαφορά μεταξύ ηλεκτρονίων σθένους και ελεύθερων ηλεκτρονίων
Κύρια διαφορά – Ηλεκτρόνια σθένους έναντι ελεύθερων ηλεκτρονίων
Ένα άτομο αποτελείται από τρεις τύπους υποατομικών σωματιδίων:ηλεκτρόνια, πρωτόνια και νετρόνια. Τα πρωτόνια και τα νετρόνια βρίσκονται στον πυρήνα του ατόμου. Τα ηλεκτρόνια βρίσκονται έξω από τον πυρήνα. Αυτά τα ηλεκτρόνια βρίσκονται σε συνεχή κίνηση γύρω από τον πυρήνα σε ορισμένες αποστάσεις. Οι οδοί στις οποίες κινούνται αυτά τα ηλεκτρόνια ονομάζονται κελύφη ηλεκτρονίων ή τροχιακά. Ένα άτομο μπορεί να έχει ένα ή περισσότερα τροχιακά. Τα ηλεκτρόνια σθένους είναι τα ηλεκτρόνια που μπορούν να βρεθούν στο εξώτατο τροχιακό ενός ατόμου. Τα ελεύθερα ηλεκτρόνια δεν συνδέονται με άτομα. Αυτά τα ηλεκτρόνια μπορούν να βρεθούν σε δομές πλέγματος. Βρίσκονται σε ελεύθερη κίνηση μέσα στο πλέγμα. Η κύρια διαφορά μεταξύ των ηλεκτρονίων σθένους και των ελεύθερων ηλεκτρονίων είναι ότι ο αριθμός των ηλεκτρονίων είναι μια στοιχειακή ιδιότητα ενώ ο αριθμός των ελεύθερων ηλεκτρονίων είναι μια ιδιότητα πλέγματος.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα ηλεκτρόνια σθένους
– Ορισμός, Παραδείγματα, Επίδραση στην Κατάσταση Οξείδωσης
2. Τι είναι τα ελεύθερα ηλεκτρόνια
– Ορισμός, Εμφάνιση
3. Ποια είναι η διαφορά μεταξύ των ηλεκτρονίων σθένους και των ελεύθερων ηλεκτρονίων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:άτομο, ατομικός αριθμός, ηλεκτρόνια, ελεύθερα ηλεκτρόνια, πλέγμα, μέταλλο, νετρόνια, πυρήνας, τροχιακό, πρωτόνια, ηλεκτρόνια σθένους

Τι είναι τα ηλεκτρόνια σθένους
Τα ηλεκτρόνια σθένους είναι ηλεκτρόνια που υπάρχουν στα εξωτερικά τροχιακά ενός ατόμου. Αυτά είναι τα ηλεκτρόνια που έχουν τη μικρότερη έλξη προς τον πυρήνα ενός ατόμου. Αυτό συμβαίνει επειδή τα ηλεκτρόνια σθένους βρίσκονται σε μεγάλη απόσταση από άλλα ηλεκτρόνια αυτού του ατόμου.
Τα ηλεκτρόνια σθένους είναι υπεύθυνα για τις χημικές αντιδράσεις και τους χημικούς δεσμούς ενός ατόμου. Δεδομένου ότι η έλξη μεταξύ των ηλεκτρονίων σθένους και του πυρήνα ενός ατόμου είναι μικρότερη, τα ηλεκτρόνια σθένους μπορούν εύκολα να αφαιρεθούν (από τα ηλεκτρόνια στα εσωτερικά τροχιακά). Αυτό είναι σημαντικό για το σχηματισμό ιοντικών ενώσεων και ομοιοπολικών ενώσεων. Χάνοντας ηλεκτρόνια σθένους, τα άτομα μπορούν να σχηματίσουν κατιόντα. Η κοινή χρήση ηλεκτρονίων σθένους ενός ατόμου με τα ηλεκτρόνια σθένους ενός άλλου ατόμου σχηματίζει ομοιοπολικούς δεσμούς.
| Ομαδοποίηση στον Περιοδικό Πίνακα | Αριθμός ηλεκτρονίων σθένους |
| Ομάδα 1 (π.χ. Na, K) | 1 |
| Ομάδα 2 (π.χ. Ca, Mg) | 2 |
| Ομάδα 13 (π.χ.:B, Al) | 3 |
| Ομάδα 14 (π.χ. C, Si) | 4 |
| Ομάδα 15 (π.χ.:N, P) | 5 |
| Ομάδα 16 (π.χ.:O, S) | 6 |
| Ομάδα 17 (π.χ. F, Cl) | 7 |
| Ομάδα 18 (π.χ.:He, Ne) | 8 |
Για τα στοιχεία μπλοκ s και τα στοιχεία μπλοκ p, τα ηλεκτρόνια σθένους βρίσκονται στο εξώτατο τροχιακό. Αλλά για τα μεταβατικά στοιχεία, τα ηλεκτρόνια σθένους μπορούν να υπάρχουν και στα εσωτερικά τροχιακά. Αυτό οφείλεται στη διαφορά ενέργειας μεταξύ των υποτροχιακών. Για παράδειγμα, ο ατομικός αριθμός του Μαγγανίου (Mn) είναι 25. Η ηλεκτρονιακή διαμόρφωση του κοβαλτίου είναι [Ar] 3d4s. Τα ηλεκτρόνια σθένους του κοβαλτίου πρέπει να βρίσκονται στο τροχιακό 4s. Υπάρχουν όμως 7 ηλεκτρόνια σθένους στο Mn. Τα ηλεκτρόνια στο τροχιακό 3d θεωρούνται επίσης ως ηλεκτρόνια σθένους επειδή το τροχιακό 3d βρίσκεται έξω από το τροχιακό 4s (η ενέργεια του 3d είναι υψηλότερη από το τροχιακό 4s).
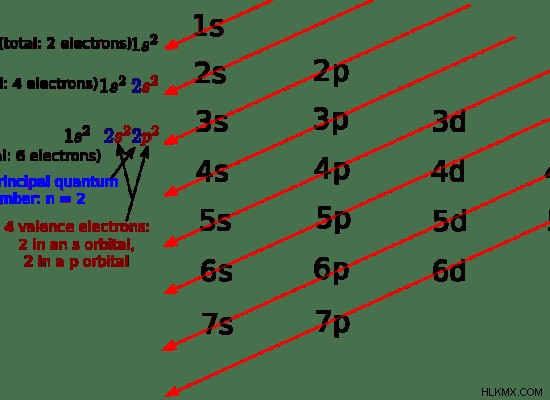
Εικόνα 1:Ηλεκτρόνια σθένους άνθρακα
Η κατάσταση οξείδωσης ενός ατόμου εξαρτάται από τα ηλεκτρόνια σθένους αυτού του ατόμου. Μερικά άτομα αφαιρούν ηλεκτρόνια σθένους για να σταθεροποιηθούν. Τότε η κατάσταση οξείδωσης αυτού του ατόμου αυξάνεται. Μερικά άτομα αποκτούν περισσότερα ηλεκτρόνια στο εξώτατο τροχιακό. Τότε ο αριθμός των ηλεκτρονίων σθένους αυτού του ατόμου αυξάνεται. Μειώνει την κατάσταση οξείδωσης του ατόμου.
Τι είναι τα ελεύθερα ηλεκτρόνια
Τα ελεύθερα ηλεκτρόνια είναι ηλεκτρόνια που δεν είναι συνδεδεμένα με ένα άτομο. Τα ελεύθερα ηλεκτρόνια δεν μπορούν να βρεθούν παντού. Αυτό συμβαίνει επειδή ένα μοναχικό ηλεκτρόνιο είναι πολύ αντιδραστικό και μπορεί να αντιδράσει με οτιδήποτε. Αλλά σε κρυσταλλικές δομές και μέταλλα, μπορούν να βρεθούν ελεύθερα ηλεκτρόνια.
Τα ελεύθερα ηλεκτρόνια είναι τα αποτοποθετημένα ηλεκτρόνια από το πλέγμα. Στις κρυσταλλικές δομές, ορισμένα ηλεκτρόνια δεν παραμένουν στη θέση τους λόγω κρυσταλλικών ελαττωμάτων. Γίνονται ελεύθερα ηλεκτρόνια που μπορούν να κινηθούν οπουδήποτε μέσα στο πλέγμα. Αυτά τα ηλεκτρόνια είναι υπεύθυνα για τη αγωγή της θερμότητας και του ηλεκτρισμού.
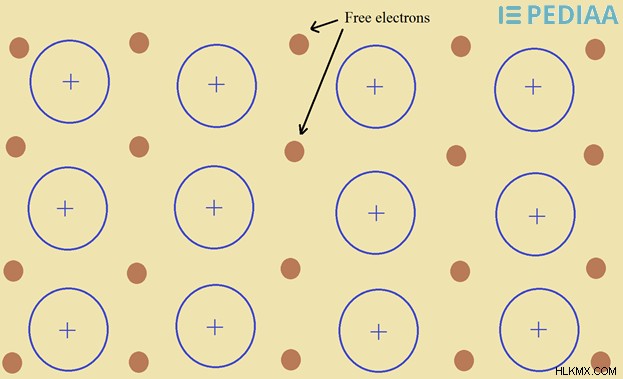
Εικόνα 2:Ελεύθερα ηλεκτρόνια σε μεταλλικό πλέγμα
Στα μέταλλα, υπάρχουν ελεύθερα ηλεκτρόνια μεταξύ των μεταλλικών ιόντων. Είναι ένα πλέγμα μεταλλικών ιόντων σε μια θάλασσα ελεύθερων ηλεκτρονίων. Αυτά τα ελεύθερα ηλεκτρόνια μπορούν να μεταφέρουν θερμότητα και ηλεκτρισμό μέσω του μετάλλου. Αυτά τα ελεύθερα ηλεκτρόνια μπορούν να μεταφέρουν ηλεκτρικό ρεύμα μέσω του μετάλλου.
Διαφορά μεταξύ ηλεκτρονίων σθένους και ελεύθερων ηλεκτρονίων
Ορισμός
Ηλεκτρόνια σθένους: Τα ηλεκτρόνια σθένους είναι τα ηλεκτρόνια που υπάρχουν στα εξωτερικά τροχιακά ενός ατόμου.
Δωρεάν ηλεκτρόνια: Τα ελεύθερα ηλεκτρόνια είναι ηλεκτρόνια που δεν είναι συνδεδεμένα με ένα άτομο.
Έλξη στον Πυρήνα
Ηλεκτρόνια σθένους: Τα ηλεκτρόνια σθένους έχουν μικρότερη έλξη προς τον πυρήνα ενός ατόμου.
Δωρεάν ηλεκτρόνια: Τα ελεύθερα ηλεκτρόνια δεν έχουν έλξη προς τον πυρήνα ενός ατόμου.
Χημικός δεσμός
Ηλεκτρόνια σθένους: Τα ηλεκτρόνια σθένους είναι υπεύθυνα για τον χημικό δεσμό ενός ατόμου.
Δωρεάν ηλεκτρόνια: Τα ελεύθερα ηλεκτρόνια δεν εμπλέκονται σε χημικούς δεσμούς.
Αγωγή θερμότητας και ηλεκτρισμού
Ηλεκτρόνια σθένους: Τα ηλεκτρόνια σθένους δεν μπορούν να μεταφέρουν θερμότητα και ηλεκτρισμό.
Δωρεάν ηλεκτρόνια: Τα ελεύθερα ηλεκτρόνια είναι υπεύθυνα για τη αγωγή της θερμότητας και του ηλεκτρισμού.
Φύση
Ηλεκτρόνια σθένους: Ο αριθμός των ηλεκτρονίων σθένους είναι μια στοιχειώδης ιδιότητα.
Δωρεάν ηλεκτρόνια: Ο αριθμός των ελεύθερων ηλεκτρονίων είναι μια ιδιότητα πλέγματος.
Συμπέρασμα
Τα ηλεκτρόνια σθένους είναι ηλεκτρόνια που είναι χαλαρά συνδεδεμένα με ένα άτομο. Τα ελεύθερα ηλεκτρόνια είναι εντελώς αδέσμευτα σε οποιοδήποτε άτομο. Τα ηλεκτρόνια σθένους είναι υπεύθυνα για τις χημικές αντιδράσεις και τους χημικούς δεσμούς των ατόμων. Τα ελεύθερα ηλεκτρόνια συμμετέχουν στην αγωγιμότητα της θερμότητας και του ηλεκτρισμού μιας δομής πλέγματος. Υπάρχουν πολλές διαφορές μεταξύ των ηλεκτρονίων σθένους και των ελεύθερων ηλεκτρονίων. Η κύρια διαφορά είναι ότι ο αριθμός των ηλεκτρονίων είναι μια στοιχειακή ιδιότητα ενώ ο αριθμός των ελεύθερων ηλεκτρονίων είναι μια ιδιότητα πλέγματος.




