Διαφορά μεταξύ σταθερών και ασταθών ισοτόπων
Κύρια διαφορά – Σταθερά έναντι ασταθών ισοτόπων
Τα ισότοπα είναι άτομα του ίδιου στοιχείου που έχουν διαφορετικές ατομικές δομές. Τα ισότοπα του ίδιου στοιχείου έχουν τον ίδιο ατομικό αριθμό αφού είναι διαφορετικές μορφές του ίδιου στοιχείου. Διαφέρουν μεταξύ τους ανάλογα με τον αριθμό των νετρονίων που έχουν στους πυρήνες τους. Η ατομική μάζα ενός στοιχείου καθορίζεται από το άθροισμα του αριθμού των πρωτονίων και του αριθμού των ηλεκτρονίων. Επομένως, οι ατομικές μάζες των ισοτόπων είναι διαφορετικές μεταξύ τους. Τα ισότοπα μπορούν να χωριστούν κυρίως σε δύο ομάδες ως σταθερά ισότοπα και ασταθή ισότοπα. Η κύρια διαφορά μεταξύ σταθερών και ασταθών ισοτόπων είναι ότι τασταθερά ισότοπα έχουν σταθερούς πυρήνες ενώ τα ασταθή ισότοπα έχουν ασταθείς πυρήνες.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα σταθερά ισότοπα
– Ορισμός, Ιδιότητες, Εφαρμογές
2. Τι είναι τα ασταθή ισότοπα
– Ορισμός, Ιδιότητες, Εφαρμογές
3. Ποια είναι η διαφορά μεταξύ σταθερών και ασταθών ισοτόπων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Άλφα διάσπαση, Ζώνη σταθερότητας, Ηλεκτρόνια, Ήλιο, Ισότοπα, Μαγικοί Αριθμοί, Νετρόνια, Πρωτόνια, Ραδιενέργεια, Ουράνιο 
Τι είναι τα Σταθερά Ισότοπα
Σταθερά ισότοπα είναι άτομα που έχουν σταθερούς πυρήνες. Είναι μη ραδιενεργά λόγω της σταθερότητας των πυρήνων τους. Επομένως, οι σταθεροί πυρήνες δεν εκπέμπουν ακτινοβολία. Ένα συγκεκριμένο στοιχείο μπορεί να έχει περισσότερα από ένα σταθερά ισότοπα. Για ορισμένα στοιχεία όπως το Ουράνιο, όλα τα ισότοπα είναι ασταθή. Τα δύο κύρια γεγονότα που καθορίζουν τη σταθερότητα των πυρήνων είναι η αναλογία πρωτονίων προς νετρόνια και το άθροισμα πρωτονίων και νετρονίων.
Το φαινόμενο "Μαγικοί αριθμοί ” είναι μια έννοια στη χημεία που περιγράφει τους ατομικούς αριθμούς των πιο σταθερών ισοτόπων. Ο μαγικός αριθμός μπορεί να είναι είτε ο αριθμός των πρωτονίων είτε ο αριθμός των νετρονίων. Εάν ένα συγκεκριμένο στοιχείο έχει έναν μαγικό αριθμό πρωτονίων ή νετρονίων, είναι σταθερά ισότοπα.
Μαγικοί αριθμοί:2, 8, 20, 28, 50, 82
Πρωτόνια:114
Τα νετρόνια:126, 184 είναι μαγικοί αριθμοί.
Επιπλέον, εάν οι αριθμοί των πρωτονίων και των νετρονίων είναι ζυγοί, αυτά τα ισότοπα είναι πιθανότατα σταθερά. Ένας άλλος τρόπος είναι ο υπολογισμός της αναλογίας πρωτονίων:νετρονίων. Υπάρχει ένα τυπικό γράφημα αριθμού νετρονίων έναντι αριθμού πρωτονίων . Εάν η αναλογία πρωτονίων:νετρονίων ταιριάζει στην περιοχή για σταθερά ισότοπα σε αυτό το γράφημα, τότε αυτά τα ισότοπα είναι ουσιαστικά σταθερά.
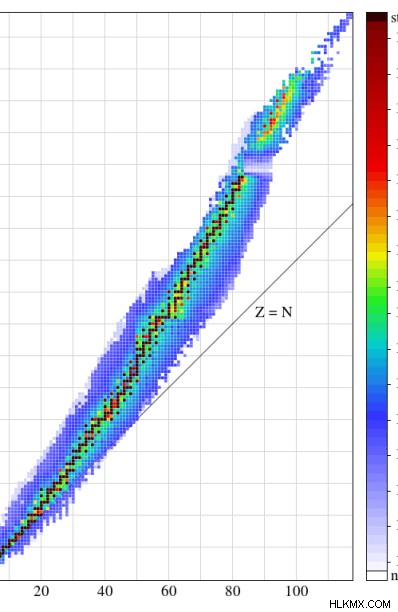
Εικόνα 1:Η γραφική παράσταση του αριθμού των νετρονίων έναντι του αριθμού των πρωτονίων. Η έγχρωμη περιοχή ονομάζεται ζώνη σταθερότητας.
Αν και τα σταθερά ισότοπα δεν είναι ραδιενεργά, έχουν πολλές εφαρμογές. Για παράδειγμα, το στοιχείο υδρογόνου έχει τρία κύρια ισότοπα. Είναι το Protium, το Deuterium και το Tritium. Το Protium είναι το πιο σταθερό και πιο άφθονο ισότοπο ανάμεσά τους. Το τρίτιο είναι το πιο ασταθές ισότοπο. Το δευτέριο είναι επίσης σταθερό, αλλά δεν είναι τόσο άφθονο στη φύση. Ωστόσο, το Protium είναι ένα ισότοπο που βρίσκεται σχεδόν παντού. Το δευτέριο μπορεί να χρησιμοποιηθεί με τη μορφή βαρέος νερού για εργαστηριακές εφαρμογές.
Ορισμένα στοιχεία έχουν μόνο ένα σταθερό ισότοπο. Αυτά τα στοιχεία ονομάζονται μονοϊσοτοπικά . Υπάρχουν 26 γνωστά μονοϊσοτοπικά στοιχεία. Άλλα στοιχεία έχουν περισσότερα από ένα σταθερά ισότοπα. Για παράδειγμα, ο Tin (Sn) έχει 10 σταθερά ισότοπα.
Τι είναι τα ασταθή ισότοπα
Ασταθή ισότοπα είναι άτομα που έχουν ασταθείς πυρήνες. Αυτά είναι ραδιενεργά ισότοπα. Ως εκ τούτου, ονομάζονται επίσης ραδιενεργά ισότοπα . Ορισμένα στοιχεία όπως το Ουράνιο έχει μόνο ραδιενεργά ισότοπα. Άλλα στοιχεία έχουν σταθερά και ασταθή ισότοπα.
Ένα ασταθές στοιχείο μπορεί να είναι ασταθές για διάφορους λόγους. Η παρουσία μεγάλου αριθμού νετρονίων σε σύγκριση με τον αριθμό των πρωτονίων είναι ένας τέτοιος λόγος. Σε αυτόν τον τύπο ισοτόπων, λαμβάνει χώρα ραδιενεργή διάσπαση προκειμένου να ληφθεί μια σταθερή κατάσταση. Εδώ, τα νετρόνια μετατρέπονται σε πρωτόνια και ηλεκτρόνια. Αυτό μπορεί να δοθεί όπως παρακάτω.
0 n → 1 p + -1 e
n είναι ένα νετρόνιο, το p είναι ένα πρωτόνιο και το e είναι ένα ηλεκτρόνιο. Η μάζα του σωματιδίου δίνεται στον κεφαλαίο αριθμό και το ηλεκτρικό φορτίο στον πεζό αριθμό.
Μερικά ισότοπα είναι ασταθή λόγω της παρουσίας μεγάλου αριθμού πρωτονίων. Εδώ, ένα πρωτόνιο μπορεί να μετατραπεί σε νετρόνιο και ποζιτρόνιο. Ένα ποζιτρόνιο είναι παρόμοιο με ένα ηλεκτρόνιο αλλά το ηλεκτρικό φορτίο είναι +1.
1 p → 0 n + 1 e
Εδώ 1 Το e δείχνει το ποζιτρόνιο.
Μερικές φορές, μπορεί να υπάρχουν πάρα πολλά πρωτόνια και πάρα πολλά ηλεκτρόνια. Αυτό δείχνει ότι η ατομική μάζα είναι πολύ υψηλή. Στη συνέχεια δύο πρωτόνια και δύο νετρόνια εκπέμπονται ως άτομο ηλίου. Αυτό ονομάζεται άλφα διάσπαση.
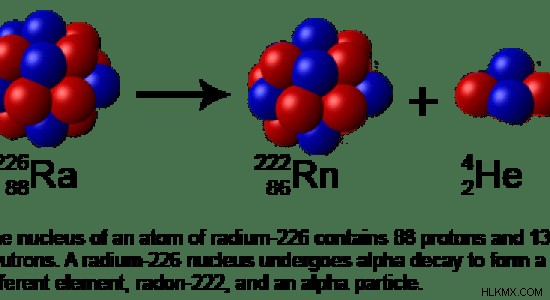
Εικόνα 2:Άλφα διάσπαση του Ραδίου-226
Τα ραδιενεργά στοιχεία έχουν πολλές εφαρμογές στην ερευνητική εργασία. Για παράδειγμα, μπορούν να χρησιμοποιηθούν για τον προσδιορισμό της ηλικίας των απολιθωμάτων, στην ανάλυση DNA ή για ιατρικούς σκοπούς κ.λπ.
Στα ασταθή ισότοπα, η ραδιενεργή διάσπαση μπορεί να μετρηθεί με τον χρόνο ημιζωής τους. Ο χρόνος ημιζωής μιας ουσίας ορίζεται ως ο χρόνος που χρειάζεται αυτή η ουσία για να γίνει το μισό της αρχικής της μάζας λόγω αποσύνθεσης.
Διαφορά μεταξύ σταθερών και ασταθών ισοτόπων
Ορισμός
Σταθερά ισότοπα: Σταθερά ισότοπα είναι άτομα που έχουν σταθερούς πυρήνες.
Ασταθή Ισότοπα: Τα ασταθή ισότοπα είναι άτομα που έχουν ασταθείς πυρήνες.
Ραδιενέργεια
Σταθερά ισότοπα: Τα σταθερά ισότοπα δεν δείχνουν ραδιενέργεια.
Ασταθή Ισότοπα: Τα ασταθή ισότοπα δείχνουν ραδιενέργεια.
Μαγικοί αριθμοί
Σταθερά ισότοπα: Οι μαγικοί αριθμοί υποδεικνύουν τον αριθμό των πρωτονίων ή τον αριθμό των νετρονίων που υπάρχουν στα πιο σταθερά ισότοπα.
Ασταθή Ισότοπα: Οι μαγικοί αριθμοί δεν υποδεικνύουν τον αριθμό των πρωτονίων ή των ηλεκτρονίων σε ασταθή ισότοπα.
Εφαρμογές
Σταθερά ισότοπα: Σταθερά ισότοπα χρησιμοποιούνται για εφαρμογές όπου δεν πρέπει να υπάρχει ραδιενέργεια.
Ασταθή Ισότοπα: Τα ασταθή ισότοπα χρησιμοποιούνται σε εφαρμογές όπου η ραδιενέργεια είναι σημαντική, όπως στην ανάλυση DNA.
Μισή ζωή
Σταθερά ισότοπα: Ο χρόνος ημιζωής ενός σταθερού ισοτόπου είναι πολύ μεγάλος ή δεν έχει καθόλου χρόνο ημιζωής.
Ασταθή Ισότοπα: Ο χρόνος ημιζωής του ασταθούς ισοτόπου είναι σύντομος και μπορεί να υπολογιστεί εύκολα.
Συμπέρασμα
Όλα τα στοιχεία στη γη μπορούν να χωριστούν σε δύο ομάδες ως σταθερά ισότοπα και ασταθή ισότοπα. Τα σταθερά ισότοπα είναι φυσικές μορφές στοιχείων που δεν είναι ραδιενεργά. Τα ασταθή ισότοπα είναι άτομα που έχουν ασταθείς πυρήνες. Επομένως, αυτά τα στοιχεία υφίστανται ραδιενέργεια. Αυτή είναι η κύρια διαφορά μεταξύ σταθερών και ασταθών ισοτόπων. Η ραδιενέργεια είναι χρήσιμη σε πολλές εφαρμογές, αλλά δεν είναι καλή για την υγεία μας, καθώς η ακτινοβολία μπορεί να προκαλέσει μεταλλάξεις στο DNA μας που μπορεί να οδηγήσουν στο σχηματισμό καρκινικών κυττάρων.




