Διαφορά μεταξύ ισοτονικού και ισομετρικού
Κύρια διαφορά – Ισοτονική έναντι ισομετρική
Και οι δύο αυτοί όροι, ισοτονικοί και ισομετρικοί, είναι χρήσιμοι στη χημεία κατά τον καθορισμό παραμέτρων μιας χημικής αντίδρασης ή διεργασίας. Το κλειδί εδώ είναι η λέξη «iso». ’. Κυριολεκτικά σημαίνει «ίδιο» ή «παρόμοιο». Επομένως, σημαίνει ότι οι σχετικές συνθήκες θα παραμείνουν οι ίδιες χωρίς να αλλάξουν όσο συμβαίνει η διαδικασία. Τονικότητα αναφέρεται στη συγκέντρωση και, επομένως, ισοτονικό θα σήμαινε ότι έχει παρόμοια συγκέντρωση. Μετρική γενικά αναφέρεται στις φυσικές διαστάσεις ενός αντικειμένου. Και ο πιο κοντινός τρόπος που θα μπορούσε να συσχετιστεί με μια χημική αντίδραση είναι μέσω του όγκου του δοχείου. Επομένως, σε μια ισομετρική διαδικασία, ο όγκος του δοχείου θα πρέπει να παραμένει αμετάβλητος καθ' όλη τη διάρκεια της αντίδρασης. Επομένως, η κύρια διαφορά μεταξύ ισοτονικού και ισομετρικού είναι ότι ο όρος ισοτονικό δηλώνει ότι η συγκέντρωση του διαλύματος είναι ίδια με ένα σύστημα αναφοράς ενώ το ισομετρικό υποδηλώνει ότι ο όγκος μιας αντίδρασης παραμένει ίδιος σε όλη την αντίδραση.
Τι είναι Ισοτονικό
Αυτός ο όρος χρησιμοποιείται συχνά στην κυτταρική βιολογία όταν συγκρίνεται η συγκέντρωση του κυτταρικού χυμού με ένα εξωτερικό διάλυμα. Όταν ένα διάλυμα είναι ισοτονικό, είναι παρόμοια σε συγκέντρωση με τον κυτταρικό χυμό. Επομένως, εάν ένα κελί τοποθετηθεί σε αυτό το είδος διαλύματος, δεν θα υπάρξει καθαρή μεταφορά του διαλύματος προς ή από το κελί. Αυτό δεν σημαίνει απαραιτήτως ότι δεν υπάρχει λύση που κινείται προς τα έξω ή δεν κινείται προς τα μέσα. Υποδηλώνει ότι οι ρυθμοί της λύσης που μετακινείται και κινείται προς τα έξω είναι παρόμοιοι. Ένα κανονικό κύτταρο θα επιβίωνε σε αυτό το είδος περιβάλλοντος.
Η διαδικασία της κίνησης του διαλύματος κατά μήκος της κυτταρικής μεμβράνης είναι γνωστή ως «όσμωση». Και εδώ, η κυτταρική μεμβράνη λειτουργεί ως ημιπερατή μεμβράνη. Υπάρχουν δύο άλλα είδη λύσεων σε αυτή την περίπτωση. Είναι δηλαδή υπερτονικοί και υποτονικοί. Υπερτονικό είναι όταν η συγκέντρωση του εξωτερικού διαλύματος είναι μεγαλύτερη από αυτή του κυτταρικού χυμού. Εδώ, το διάλυμα θα αρχίσει να ρέει από το κύτταρο προς τα έξω έως ότου η συγκέντρωση είναι ίση και στις δύο πλευρές της κυτταρικής μεμβράνης. Ένα κύτταρο, σε αυτή την περίπτωση, θα υποφέρει από αφυδάτωση. Υποτονικό είναι όταν η συγκέντρωση του εξωτερικού διαλύματος είναι χαμηλότερη από αυτή του κυτταρικού χυμού. Σε αυτή την περίπτωση, το διάλυμα θα έρεε μέσα στο κύτταρο και θα προκαλούσε τη διόγκωσή του. Επομένως, ένα κύτταρο θα μπορούσε να επιβιώσει μόνο όταν βρίσκεται σε ισοτονικό διάλυμα. 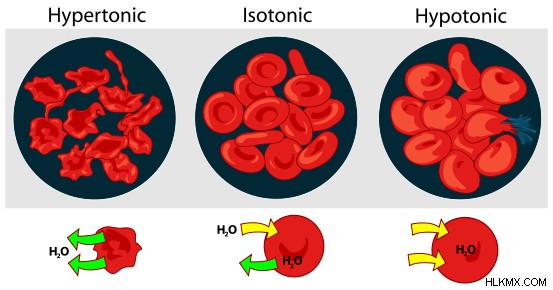
Τι είναι η ισομετρική
Γενικά, όταν συμβαίνει μια χημική αντίδραση, υπάρχει σημαντική αλλαγή στις φυσικές ιδιότητες της αντίδρασης. Υπάρχουν αλλαγές στην πίεση, τον όγκο και τη θερμοκρασία. Ωστόσο, είναι επίσης δυνατό να διατηρηθούν ορισμένες ιδιότητες ως σταθερές ενώ αφήνουμε τις άλλες να αλλάζουν. Αυτοί οι τύποι τεχνικών χρησιμοποιούνται συνήθως όταν γίνονται ερευνητικά πειράματα. Εδώ, ισομετρική σημαίνει όταν μια αντίδραση συμβαίνει υπό σταθερό όγκο. Επομένως, γενικά, οι αντιδράσεις που πραγματοποιούνται σε ένα σφραγισμένο δοχείο μπορούν να δοθούν ως παράδειγμα.
Λαμβάνοντας υπόψη τις άλλες ιδιότητες, ισόθερμο σημαίνει ότι η θερμοκρασία διατηρείται σταθερή και ισοβαρική σημαίνει ότι η πίεση διατηρείται σταθερή. 
Διαφορά μεταξύ ισοτονικού και ισομετρικού
Ορισμός
Ισοτονικό σημαίνει ότι η συγκέντρωση του διαλύματος είναι ίδια με ένα σύστημα αναφοράς.
Ισομετρική είναι όταν ο όγκος μιας αντίδρασης παραμένει ίδιος σε όλη την αντίδραση.
Χρήση
Ισοτονικό χρησιμοποιείται συνήθως στην κυτταρική βιολογία.
Ισομετρική μπορεί να εφαρμοστεί σε οποιαδήποτε χημική αντίδραση.
Αρχή της κίνησης
Ισοτονικό περιλαμβάνει τη φυσική αρχή της όσμωσης.
Ισομετρική δεν περιλαμβάνει όσμωση ή οποιαδήποτε αρχή κίνησης.
Αναφορά
Η λέξη ισότονη χρησιμοποιείται για να περιγράψει μια ιδιότητα μιας λύσης.
Η λέξη ισομετρική σχετίζεται γενικά με τον χώρο και τον όγκο. 




