Τι είναι μια χημική εξίσωση; Ορισμός και Παραδείγματα
Μια χημική εξίσωση είναι μια συμβολική αναπαράσταση μιας χημικής αντίδρασης, που υποδεικνύει τα αντιδρώντα και τα προϊόντα σε μια αντίδραση και την κατεύθυνση προς την οποία εξελίσσεται η αντίδραση. Ο Γάλλος χημικός Jean Beguin παίρνει τα εύσημα για τη διατύπωση της πρώτης χημικής εξίσωσης το 1615.
Ακολουθεί μια επεξήγηση των τύπων των χημικών εξισώσεων, των μερών που περιέχουν και των παραδειγμάτων.
Μέρη μιας χημικής εξίσωσης
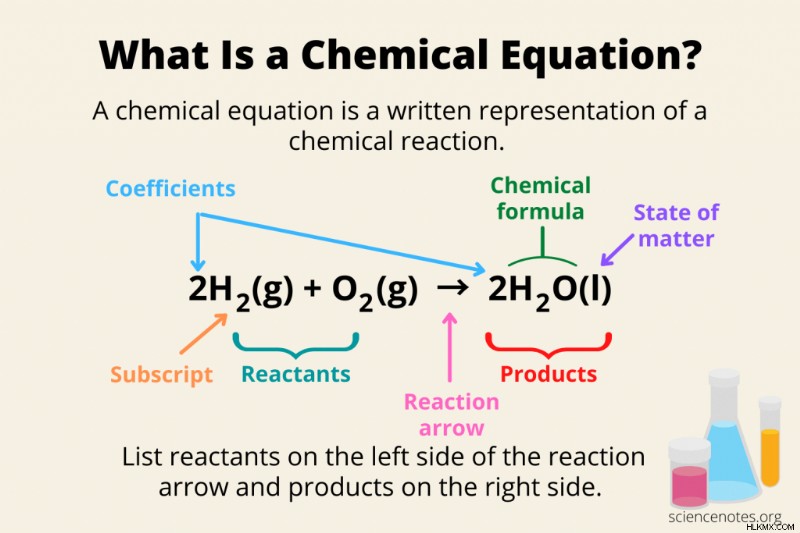
Τα τρία βασικά μέρη μιας χημικής εξίσωσης είναι τα αντιδρώντα, τα προϊόντα και το βέλος αντίδρασης, αλλά πολλές εξισώσεις περιέχουν πολύ περισσότερες πληροφορίες.
- Χημικοί τύποι :Τα αντιδρώντα και τα προϊόντα γράφονται ως χημικοί τύποι, χρησιμοποιώντας σύμβολα στοιχείων και δείκτες.
- Αντιδρώντα :Κατά σύμβαση, οι χημικές αντιδράσεις διαβάζονται από αριστερά προς τα δεξιά. Τα αντιδρώντα γράφονται στην αριστερή πλευρά της εξίσωσης. Η σχεδίαση των χημικών δομών των αντιδρώντων είναι καλή, αλλά η συνήθης μέθοδος δίνει τους χημικούς τύπους των αντιδρώντων (π.χ. H2 , O2 ).
- Προϊόντα :Τα προϊόντα μιας χημικής αντίδρασης γράφονται στη δεξιά πλευρά του βέλους της αντίδρασης.
- Βέλος αντίδρασης :Το βέλος της αντίδρασης δείχνει σε ποια κατεύθυνση προχωρά η χημική αντίδραση.
- Σύμβολα συν :Όταν εμφανίζονται περισσότερα από ένα αντιδραστήρια ή προϊόντα, χρησιμοποιήστε ένα σύμβολο συν (+) μεταξύ τους.
- Συντελεστές :Οι συντελεστές είναι αριθμοί που γράφονται μπροστά από έναν χημικό τύπο. Υποδεικνύουν τη στοιχειομετρία των αντιδρώντων και των προϊόντων, ώστε να μπορείτε να δείτε με μια ματιά τη μοριακή αναλογία μεταξύ τους σε μια ισορροπημένη εξίσωση. Για παράδειγμα, στον τύπο 4H2 O2 , "4" είναι ο συντελεστής. Κατά σύμβαση, ο αριθμός «1» παραλείπεται. Έτσι, γράφετε O2 και όχι 1O2 . Συνήθως, οι συντελεστές είναι ακέραιοι αριθμοί, αλλά μερικές φορές θα δείτε εξισώσεις που χρησιμοποιούν κλάσματα ή δεκαδικά ψηφία.
- Συνδρομές :Οι δείκτες ακολουθούν το σύμβολο του στοιχείου σε έναν χημικό τύπο, υποδεικνύοντας πόσα άτομα αυτού του στοιχείου υπάρχουν σε μια ένωση. Για παράδειγμα, το "2" στο H2 Το O είναι δείκτης.
- Κατάσταση της ύλης :Δεν αναφέρουν όλες οι χημικές εξισώσεις την κατάσταση της ύλης των αντιδρώντων και των προϊόντων. Όμως, όταν δίνεται, η κατάσταση της ύλης ακολουθεί τον χημικό τύπο ενός αντιδρώντος ή προϊόντος, που περικλείεται μέσα σε παρενθέσεις. Οι συντομογραφίες για τις καταστάσεις της ύλης είναι (s) για στερεό, (l) για υγρό, (g) για αέριο και (aq) για όταν ένα είδος διαλύεται σε υδατικό διάλυμα.
Βέλος αντίδρασης σε μια χημική εξίσωση
Ο τύπος του βέλους αντίδρασης περιγράφει την κατεύθυνση προς την οποία εξελίσσεται η χημική αντίδραση:
- Το πιο συνηθισμένο βέλος αντίδρασης δείχνει από αριστερά προς τα δεξιά. Το σύμβολο → σημαίνει ότι η αντίδραση προχωρά σε μια καθαρή προς τα εμπρός κατεύθυνση, όπου τα αντιδρώντα αντιδρούν και παράγουν προϊόντα.
- Ορισμένες εξισώσεις απεικονίζουν την ισορροπία. Το σύμβολο ⇌ υποδηλώνει μια κατάσταση χημικής ισορροπίας μεταξύ των αντιδρώντων και των προϊόντων. Η αντίδραση προχωρά και προς τις δύο κατευθύνσεις, με τις δύο πλευρές της εξίσωσης να δρουν ταυτόχρονα ως αντιδρώντα και προϊόντα. Εάν το ένα βέλος είναι μικρότερο από το άλλο, τότε το μακρύτερο βέλος αντιπροσωπεύει την κύρια κατεύθυνση στην οποία προχωρά η αντίδραση, ενώ το μικρότερο βέλος υποδεικνύει ότι η αντίδραση εξακολουθεί να συμβαίνει προς αυτήν την κατεύθυνση, αλλά δεν ευνοείται.
- Το σύμβολο ⇄ σημαίνει ότι η αντίδραση προχωρά τόσο προς τα εμπρός όσο και προς τα πίσω.
- Το σύμβολο ίσου ή =υποδηλώνει στοιχειομετρική σχέση.
Μη ισορροπημένες και ισορροπημένες χημικές εξισώσεις
Οι χημικές εξισώσεις είναι είτε μη ισορροπημένες είτε ισορροπημένες.
- Μια μη ισορροπημένη χημική εξίσωση παραθέτει τα αντιδρώντα και τα προϊόντα και την κατεύθυνση που προχωρά η αντίδραση, αλλά δεν καθορίζει μια μοριακή αναλογία μεταξύ αντιδρώντων και προϊόντων.
Παράδειγμα:H2 + O2 → H2 Ο
- Μια ισορροπημένη χημική εξίσωση περιλαμβάνει συντελεστές πριν από τους χημικούς τύπους και υποδεικνύει τη στοιχειομετρική αναλογία μεταξύ αντιδρώντων και προϊόντων. Μια ισορροπημένη χημική εξίσωση περιέχει ίσους αριθμούς και τύπους ατόμων και στις δύο πλευρές του βέλους της αντίδρασης. Είναι ισορροπημένο τόσο για μάζα όσο και για φόρτιση.
Παράδειγμα:2H2 + O2 → 2H2 O
Ιονικές χημικές εξισώσεις
Οι ιοντικές χημικές εξισώσεις υποδεικνύουν το καθαρό ηλεκτρικό φορτίο στα αντιδρώντα και τα προϊόντα. Σε μια ισορροπημένη ιοντική εξίσωση, το καθαρό ηλεκτρικό φορτίο είναι το ίδιο και στις δύο πλευρές του βέλους της αντίδρασης.
Παράδειγμα:2Ag(aq) + Cr2 O7 (aq) → Ag2 Cr2 O7 (s)
Σημειώστε ότι πολλαπλασιάζετε τον συντελεστή με τη χρέωση. Σε αυτό το παράδειγμα, υπάρχουν δύο χρεώσεις «+» για το ιόν αργύρου και δύο χρεώσεις «-» για το ιόν χρωμίου. Αυτά τα φορτία αλληλοεξουδετερώνονται, αφήνοντας ένα καθαρό ουδέτερο φορτίο στην πλευρά των αντιδρώντων της εξίσωσης [2(+1) + 1(−2) =0]. Το προϊόν, ο χρωμικός άργυρος, είναι ηλεκτρικά ουδέτερο.
Αναφορές
- Brady, James E.; Senese, Frederick; Jespersen, Neil D. (2007). Χημεία:Ύλη και οι αλλαγές της . John Wiley &Sons. ISBN 9780470120941.
- IUPAC (1997). "Εξίσωση χημικής αντίδρασης." Σύνοψη Χημικής Ορολογίας (2η έκδ.) (το «Χρυσό Βιβλίο»). Oxford:Blackwell Scientific Publications. ISBN 0-9678550-9-8. doi:10.1351/goldbook
- Marshall, Hugh (1902). «Προτεινόμενες Τροποποιήσεις του Σήματος Ισότητας για Χρήση στη Χημική Σημείωση». Πρακτικά της Βασιλικής Εταιρείας του Εδιμβούργου . 24:85–87. doi:10.1017/S0370164600007720
- Myers, Richard (2009). Τα Βασικά της Χημείας . Greenwood Publishing Group. ISBN 978-0-313-31664-7.
- van ‘t Hoff, J.H. (1884). Études de Dynamique Chemique [Μελέτες χημικής δυναμικής] (στα γαλλικά). Άμστερνταμ, Ολλανδία:Frederik Muller &Co.




