Εξίσωση Clausius Clapeyron
Η εξίσωση Clausius Clapeyron είναι μια σχέση που περιγράφει τη μετάβαση φάσης μεταξύ της υγρής και της ατμικής φάσης της ύλης. Ανάλογα με τη μορφή της εξίσωσης, προβλέπει την τάση ατμών ενός υγρού ή τη θερμότητα της εξάτμισης από τις πιέσεις ατμών σε δύο θερμοκρασίες. Μια άλλη χρήση είναι η πρόβλεψη εάν θα συμβεί ή όχι μια μετάβαση φάσης υπό ορισμένες συνθήκες.
Η υπόθεση είναι ότι οι καμπύλες εξάτμισης των περισσότερων υγρών έχουν παρόμοια σχήματα. Σε ένα ορισμένο εύρος, η μεταβολή της τάσης ατμών ως συνάρτηση της θερμοκρασίας είναι μια σχεδόν γραμμική σχέση. Με άλλα λόγια, η τάση ατμών αυξάνεται καθώς αυξάνεται η θερμοκρασία.
Η εξίσωση πήρε το όνομά της για τους Rudolf Clausius και Benoît Paul Émile Clapeyron. Ονομάζεται επίσης εξίσωση Clapeyron ή σχέση Clausius-Clapeyron. Όποιο όνομα κι αν επιλέξετε, η εξίσωση βρίσκει χρήση στη φυσική χημεία, τη θερμοδυναμική και τη μετεωρολογία.
Τύπος εξίσωσης Clausius Clapeyron
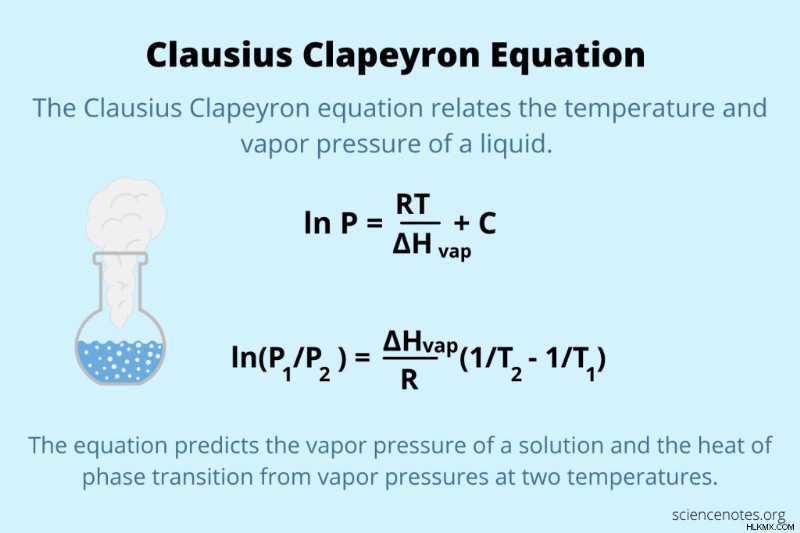
Υπάρχουν πολλές ισοδύναμες μορφές της εξίσωσης Clausius Clapeyron, συμπεριλαμβανομένων ορισμένων μορφών που είναι διαφορικές εξισώσεις. Όμως, οι πιο συνηθισμένες μορφές απλώς συνδέουν τη θερμότητα εξάτμισης, τη θερμοκρασία και την τάση ατμών ή αλλιώς την τάση ατμών και τις αντίστοιχες θερμοκρασίες για μια χημική ουσία.
ln P =RT/ ΔHvap + Γ
ln P =– ΔHvap /RT + C
ln(P1 /P2 ) =ΔHvap/R (1/T2 – 1/T1 )
ln(P1 /P2 ) =– ΔHvap/R(1/T1 – 1/T2 )
ln(P2 /P1 ) =– ΔHvap/R(1/T2 – 1/T1 )
Εδώ, το P είναι η τάση ατμών, το R είναι η ιδανική σταθερά αερίου (0,008314 kJ/K·mol), το ΔHvap είναι η θερμότητα της εξάτμισης μιας ουσίας, το T είναι η απόλυτη θερμοκρασία (σε Kelvin) και το C είναι μια σταθερά.
Η μοριακή ενθαλπία της εξάτμισης ενός υγρού είναι πάντα θετικός αριθμός, επομένως η εξίσωση Clausius Clapeyron προβλέπει ότι η τάση ατμών αυξάνεται πάντα όσο αυξάνεται η θερμοκρασία. Σημειώστε ότι ενώ μπορείτε να χρησιμοποιήσετε την εξίσωση σε ολόκληρη την καμπύλη εξάτμισης, η πρόβλεψη αποκλίνει από τις πειραματικές τιμές επειδή η ενθαλπία της εξάτμισης ποικίλλει ελαφρώς ανάλογα με τη θερμοκρασία.
Παράδειγμα προβλήματος της εξίσωσης Clausius Clapeyron
Για παράδειγμα, μπορούμε να χρησιμοποιήσουμε την εξίσωση Clausius Clapeyron για την πρόβλεψη της τάσης ατμών ενός διαλύματος. Υπολογίστε την τάση ατμών της 1-προπανόλης στους 52,8 °C εάν η τάση ατμών είναι 10,0 torr στους 14,7 °C και η θερμότητα εξάτμισης είναι 47,2 kJ/mol.
Το πρώτο βήμα είναι η μετατροπή μονάδων ώστε να λειτουργούν στην εξίσωση. Μετατροπή θερμοκρασιών Κελσίου σε Kelvin:
TK =°C + 273,15
T1 =14,7 °C + 273,15
T1 =287,85 Κ
T2 =52,8 °C + 273,15
T2 =325,95 K
Στη συνέχεια, εφαρμόστε την εξίσωση Clausius Clapeyron και λύστε το P2 :
ln(P1 /P2 ) =ΔHvap/R (1/T2 – 1/T1 )
ln[10 torr/P2 ] =(47,2 kJ/mol/0,008314 kJ/K·mol)[1/325,95 K – 1/287,85 K]
ln[10 torr/P2 ] =5677(-4,06 x 10)
ln[10 torr/P2 ] =-2,305
Πάρτε τον αντίλογο και των δύο πλευρών της εξίσωσης:
10 torr/P2 =0,997
P2 /10 torr =10,02
P2 =100,2 torr
Εφαρμογή της εξίσωσης στα στερεά
Οι περισσότεροι υπολογισμοί που χρησιμοποιούν την εξίσωση Clausius Clapeyron περιλαμβάνουν τη μετάβαση φάσης μεταξύ της υγρής και της αέριας φάσης. Όμως, η εξίσωση ισχύει και για την εξάχνωση.
Για παράδειγμα, υπολογίστε τη θερμότητα της ενθαλπίας για την εξάχνωση του πάγου εάν οι πιέσεις ατμών του πάγου στους 268 K και 273 K είναι 2.965 και 4.560 torr, αντίστοιχα.
ΔHsub =R ln(P2 / P1 ) / (1/T1 – 1/T2 )
ΔHsub =R ln(P273 / P268 ) / (1/268 – 1/273)
ΔHsub =(0,008314 kJ/K·mol) ln(4,560 / 2,965) / (1/268 – 1/273)
ΔHsub =52.370 kJ/mol
Αναφορές
- Callen, H.B. (1985). Θερμοδυναμική και Εισαγωγή στη Θερμοστατική . Wiley. ISBN 978-0-471-86256-7.
- Clapeyron, M. C. (1834). «Mémoire sur la puissance motrice de la chaleur». Journal de l'École polytechnique (στα γαλλικά). 23:153–190.
- Clausius, R. (1850). «Ueber die bewegende Kraft der Wärme und die Gesetze, welche sich daraus für die Wärmelehre selbstableiten lassen» [Σχετικά με την κινητήρια δύναμη της θερμότητας και τους νόμους που μπορούν να συναχθούν από αυτήν σχετικά με τη θεωρία της θερμότητας]. Annalen der Physik (στα γερμανικά). 155 (4):500–524. doi:10.1002/andp.18501550403
- Iribarne, J.V.; Godson, W.L. (2013). «4. Συστήματα νερού-αέρα § 4.8 Εξίσωση Clausius–Clapeyron». Ατμοσφαιρική Θερμοδυναμική . Πηδών. ISBN 978-94-010-2642-0.
- Wark, Kenneth (1988) [1966]. «Γενικευμένες Θερμοδυναμικές Σχέσεις». Θερμοδυναμική (5η έκδ.). Νέα Υόρκη, Νέα Υόρκη:McGraw-Hill, Inc. ISBN 978-0-07-068286-3.
- Yau, M.K.; Rogers, R.R. (1989). Σύντομο μάθημα στο Cloud Physics (3η έκδ.). Butterworth–Heinemann. ISBN 978-0-7506-3215-7.




