Ανυδρίτες οξέων – Ορισμός, Δομή, Ιδιότητες &Χρήσεις
Ένας ανυδρίτης είναι ένα χημικό προϊόν που σχηματίζεται με την αφαίρεση ενός μορίου νερού από ένα οξύ. Τώρα, τι είναι ο ανυδρίτης; Ένα άτομο οξυγόνου συνδέει δύο ομάδες ακυλίου, οι οποίες ορίζουν μια λειτουργική ομάδα. Ανυδρίτης σημαίνει "χωρίς νερό". Μπορείτε να το περιγράψετε ως τη χημική ουσία που δημιουργείται όταν αφαιρείται το νερό από μια άλλη χημική ουσία. Ο ανυδρίτης και το νερό μπορούν να συνδυαστούν για να σχηματίσουν μια βάση ή ένα οξύ. Ένας μικτός ανυδρίτης παράγεται από δύο διαφορετικά καρβοξυλικά οξέα και ορίζεται ότι έχει διαφορετικές ομάδες R στη γενική δομή που απεικονίζεται παρακάτω. Ας μάθουμε τώρα για τους Ανυδρίτες οξέων.
Ορισμός και έννοια του ανυδρίτη οξέος
Τα οξείδια μη μετάλλων που αντιδρούν με το νερό για να σχηματίσουν όξινα διαλύματα ονομάζονται ανυδρίτες οξέος. Αυτό είναι ένα μόριο που μπορεί να σχηματίσει όξινα διαλύματα στο νερό. Είναι μια λειτουργική ομάδα στην οργανική χημεία που αποτελείται από δύο ομάδες ακυλίου που ενώνονται με ένα άτομο οξυγόνου. Τα αμέταλλα που μπορούν να αντιδράσουν με το νερό ονομάζονται αυστηρά ανυδρίτες, ενώ τα αμέταλλα που δεν μπορούν να αντιδράσουν με το νερό δεν θεωρούνται ανυδρίτες.
Σύμφωνα με την οργανική χημεία, οι ανυδρίτες οργανικών οξέων έχουν τη λειτουργική ομάδα R(CO)O(CO)R’. Ένας ανυδρίτης οργανικού οξέος συχνά σχηματίζεται όταν ένα ισοδύναμο νερού αφαιρείται από δύο ισοδύναμα ενός οργανικού οξέος σε μια αντίδραση αφυδάτωσης.
Δομή ενός γενικού ανυδρίτη οξέος
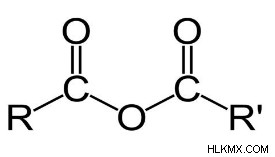
Εδώ τα R και R είναι οποιεσδήποτε ομάδες αλκανίων.
Φόρμουλα οξικού ανυδρίτη
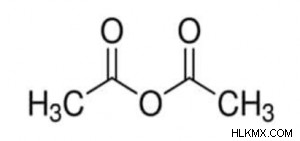
Αυτό είναι μόριο οξικού ανυδρίτη. Τα R και R' από πάνω όταν αντικατασταθούν από ομάδες μεθανίου (CH3) μας δίνουν τον τύπο οξικού ανυδρίτη. Αυτό το μόριο είναι ένα από τα βασικά παραδείγματα ανυδριδίων οξέων.
Σύνθεση ανυδρίτη οξέος
Οι ανυδρίτες οξέων είναι ουσίες με δύο ομάδες ακυλίου (R-C=O) συνδεδεμένες στο ίδιο άτομο οξυγόνου. Όταν ένα καρβοξυλικό οξύ συνδυάζεται με ένα χλωρίδιο οξέος, αυτή η αντίδραση συχνά καταλήγει στον ανυδρίτη παρουσία μιας βάσης. Δύο καρβοξυλικά οξέα θερμαίνονται σε υψηλή θερμοκρασία 800°C ή υψηλότερη για να παραχθεί ένας ανυδρίτης οργανικού οξέος. Σε αυτό το βήμα, τα μόρια νερού απομακρύνονται από την αντίδραση. Τα καρβοξυλικά οξέα μπορούν να χρησιμοποιηθούν για να αντιδράσουν και να παράγουν P2 O5 .
Η μέθοδος αφυδάτωσης δείχνει τη χημική αντίδραση της σύνθεσης ανυδρίτη οξέος.
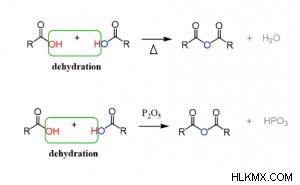
Εδώ R είναι οποιαδήποτε ομάδα αλκανίων.
Φυσικές ιδιότητες ανυδρίτες οξέος
Ας εξετάσουμε τον οξικό ανυδρίτη ως χαρακτηριστικό παράδειγμα των φυσικών του ιδιοτήτων.
Εμφάνιση – Ο οξικός ανυδρίτης, γνωστός και ως οξικός ανυδρίτης, είναι ένα άχρωμο υγρό με τη χαρακτηριστική οσμή του ξιδιού (οξικό οξύ). Η οσμή παράγεται όταν ο οξικός ανυδρίτης συνδυάζεται με υδρατμούς στον αέρα και υγρασία στη μύτη για να αναμορφώσει το οξικό οξύ. Αυτή η αντίδραση με νερό περιγράφεται αναλυτικά σε άλλη σελίδα.
Υδατοδιαλυτότητα – Ο οξικός ανυδρίτης συνδυάζεται με το νερό για να σχηματίσει οξικό οξύ, επομένως δεν μπορούμε να πούμε ότι είναι διαλυτός στο νερό. Υδατικά διαλύματα οξικού ανυδρίτη δεν υπάρχουν.
Σημείο βρασμού – η απόλυτη αιθανόλη βράζει στους 140 °C. Είναι μάλλον μεγάλα πολικά μόρια με διπολικές δυνάμεις και δυνάμεις διασποράς van der Waals. Ωστόσο, δεν σχηματίζει δεσμούς υδρογόνου. Αυτό υποδηλώνει χαμηλότερο σημείο βρασμού από ένα αντίστοιχου μεγέθους καρβοξυλικό οξύ. Για παράδειγμα, το πεντανοϊκό οξύ είναι το πλησιέστερο σε μέγεθος οξύ και βράζει στους 186 °C.
Δραστικότητα ανυδριδίων οξέος
- Σύγκριση ανυδριδίων οξέων και χλωριδίων οξέων (χλωρίδια οξέων). Ίσως ολοκληρώσατε πρόσφατα έρευνα για τα ακυλοχλωρίδια και εργάζεστε ταυτόχρονα σε ανυδρίτες οξέων ως ακυλοχλωρίδια.
- Αντί να προσπαθείτε να μάθετε τα πάντα για τους ανυδρίτες οξέων από την αρχή, είναι πολύ πιο εύκολο να τους σκεφτείτε ως κάποιο τροποποιημένο χλωρίδιο οξέος. Αυτή είναι η στάση που θέλω να κρατήσω σε αυτό το τμήμα.
- Μια πιο προσεκτική εξέταση της χρωματικής κωδικοποίησης στο σχήμα βοηθά στη σύγκριση των δομών των ανυδριδίων οξέος και των χλωριδίων οξέος.
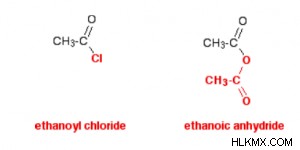
Η κάτω κόκκινη ομάδα δεν διασπάται ποτέ στην αντίδραση αιθανοϊκού ανυδρίτη. Όπως το άτομο χλωρίου στο ακυλοχλωρίδιο, μοιάζει με ένα μόνο άτομο από πολλές απόψεις. Τα ακυλοχλωρίδια συχνά αντιδρούν αντικαθιστώντας το χλώριο με άλλη ουσία. Χρησιμοποιώντας το αιθανοϋλοχλωρίδιο ως παράδειγμα, η πρώτη αντίδραση θα ήταν:

Παράγεται αέριο υδροχλώριο, το οποίο μπορεί αργότερα να αντιδράσει με άλλα συστατικά του συνδυασμού. Ένας ανυδρίτης επιβραδύνει την αντίδραση, αλλά η κύρια διαφορά είναι ότι το οξικό οξύ σχηματίζεται ως παραπροϊόν αντί για υδροχλώριο.
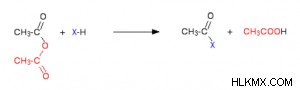
Αυτό, όπως το υδροχλώριο, μπορεί να συνεχίσει να αλληλεπιδρά με άλλα περιβαλλοντικά στοιχεία. Το νερό, οι αλκοόλες και οι φαινόλες, η αμμωνία και οι αμίνες και άλλες ουσίες συμμετέχουν στις αντιδράσεις ακυλοχλωριδίου και ανυδρίτη. Σε καθεμία από αυτές τις συγκεκριμένες καταστάσεις, υπάρχει ένα εξαιρετικά ηλεκτραρνητικό στοιχείο με ένα ενεργό μοναχικό ζεύγος (οξυγόνο ή άζωτο).
Χημικές ιδιότητες του ανυδρίτη οξέος
Με την αλλαγή της ομάδας -OCOR, ο ανυδρίτης οξέος υφίσταται μια πυρηνόφιλη αντίδραση υποκατάστασης. Η υψηλότερη ηλεκτραρνητικότητα του ατόμου Cl σε σύγκριση με την ομάδα -OCOR το καθιστά λιγότερο αντιδραστικό από το χλωριούχο οξύ.

Εδώ τα R,R| και R2 είναι οποιεσδήποτε ομάδες αλκανίων.
Σχηματισμός ανθρακικού οξέος
Το ανθρακικό οξύ παράγεται όταν αντιδρούν διοξείδιο του άνθρακα και νερό. Ο χημικός τύπος του ανθρακικού οξέος δίνεται παρακάτω.
CO 2 (ζ) + Η 2 O → H 2 ΣΥν 3 (aq)
Το διοξείδιο του άνθρακα μπορεί να αλληλεπιδράσει με το νερό και να απελευθερώσει υδρογόνο για να σχηματίσει όξινο ανθρακικό οξύ ή H2 CO3 . Η όξινη βροχή είναι το αποτέλεσμα αυτής της διαδικασίας. Σημαντικό για την αλλαγή του pH των ρεμάτων, των ποταμών και των ωκεανών. Η παραπάνω εξίσωση δείχνει ότι η αύξηση της ποσότητας διοξειδίου του άνθρακα στον αέρα παράγει απειλητικό για τη ζωή διοξείδιο του άνθρακα. Το κύριο πρόβλημα που εργαζόμαστε αυτήν τη στιγμή είναι αυτό.
Σχηματισμός θειικού οξέος:
Το τριοξείδιο του θείου και το νερό συνδυάζονται για να σχηματίσουν θειικό οξύ. Θα εξηγήσει χημικά. Στη συνέχεια σχηματίζεται θειικό οξύ όταν αλληλεπιδρούν το αέριο τριοξειδίου του θείου και το νερό.
Λοιπόν 3 (ζ) + Η 2 O → H 2 ΕΤΣΙ 4 (aq)
Το τριοξείδιο του θείου σχηματίζεται όταν το διοξείδιο του θείου ενώνεται με το οξυγόνο του αέρα. Η όξινη βροχή σχηματίζεται όταν αντιδρά με το νερό όταν βρέχει. Αυτά έχουν πολύ αρνητικό αντίκτυπο στο οικοσύστημα.
Μάθετε περισσότερα για τον οξικό ανυδρίτη
- Ο οξικός ανυδρίτης είναι ένα από τα απλούστερα παραδείγματα ανυδριδίων οξέος. Χημικά, ο τύπος για τον οξικό ανυδρίτη, που ονομάζεται επίσης οξικός ανυδρίτης, είναι (CH3 CO)2 O. Συχνά αναφέρεται ως Ac2 O, είναι ο πιο εύκολα διαχωρισμένος ανυδρίτης καρβοξυλικών οξέων. Είναι ένα κοινό αντιδραστήριο στη σύνθεση οργανικών ενώσεων. Είναι ένα λευκό υγρό που αντιδρά με την υγρασία του αέρα και παράγει οξικό οξύ και έχει έντονη οσμή οξικού οξέος.
- Το οξικό οξύ μπορεί να αφυδατωθεί στους 800 °C για την παραγωγή οξικού ανυδρίτη. Εναλλακτικά, ο οξικός ανυδρίτης και το άλας παράγονται όταν το χλωριούχο οξύ αντιδρά με ένα άλας οξικού οξέος όπως το οξικό νάτριο. Ο τύπος οξικού ανυδρίτη μπορεί επίσης να απεικονιστεί ως:
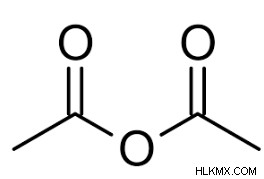
Ιδιότητες του οξικού ανυδρίτη
- Όνομα IUPAC:Οξεικός ανυδρίτης
- Ταξινόμηση:Ανυδρίτης οργανικού οξέος
- Διαλυτό σε:Νερό, Βενζόλιο
- Τύπος:C4 H6 O3
- Πυκνότητα οξικού ανυδρίτη:1,08 g/cm³
- Οξεικός ανυδρίτης Μοριακή μάζα:102,09 g/mol
- Σημείο βρασμού:139,5 °C
Η πυκνότητα οξικού ανυδρίτη είναι 1,072 g/ml. Το νερό δεν μπορεί να απορροφήσει οξικό ανυδρίτη. Η πυκνότητα του οξικού ανυδρίτη είναι ελαφρώς μεγαλύτερη από αυτή του νερού, με πυκνότητα 0,999 g/mL. Η τιμή pKa του οξικού ανυδρίτη, που είναι μικρότερη από το μηδέν και έχει αρκετά υψηλή οξύτητα, είναι -6,9. Μικρότερες από το μηδέν τιμές pKa βρίσκονται στα ισχυρά οξέα. Το οξύ είναι πιο ισχυρό και τόσο χαμηλότερη είναι η τιμή pKa. Η μοριακή μάζα του οξικού ανυδρίτη βρέθηκε να είναι 102,09 g/mol. Η μοριακή μάζα του νερού είναι περίπου 18,015 g/mol. Επομένως, η μοριακή μάζα του οξικού ανυδρίτη είναι σχεδόν πενταπλάσια από αυτή του νερού.
Δομή και ιδιότητες του οξικού ανυδρίτη
Όπως οι περισσότεροι ανυδρίτες οξέος, ο οξικός ανυδρίτης είναι ένα ελατό μόριο με μη επίπεδο σχήμα. Σε σύγκριση με την απώθηση διπόλου-διπόλου μεταξύ των δύο καρβονυλ οξυγόνων, η σύζευξη του συστήματος pi μέσω του κεντρικού οξυγόνου παρέχει σχετικά μέτρια σταθερότητα συντονισμού. Υπάρχουν σχετικά λίγα ενεργειακά εμπόδια για τη σύζευξη περιστροφής μεταξύ ιδανικών διαμορφώσεων χωρίς επίπεδα.
Χρήσεις οξικού ανυδρίτη
- Ο οξικός ανυδρίτης, όπως προτείνεται από την οργανική χημεία, χρησιμοποιείται κυρίως για ακετυλίωση που οδηγεί σε εμπορικά σημαντικά προϊόντα.
- Η κύρια χρήση του είναι η μετατροπή της κυτταρίνης σε οξική κυτταρίνη. Η οξική κυτταρίνη χρησιμοποιείται για την κατασκευή φίλτρων τσιγάρων και αποτελεί δομικό στοιχείο φωτογραφικού φιλμ και άλλων επικαλυμμένων υλικών.
- Χρησιμοποιείται σε αυτή τη διαδικασία, όπως το πώς το σαλικυλικό οξύ μετατρέπεται σε ασπιρίνη, που ονομάζεται επίσης ακετυλοσαλικυλικό οξύ.
- Χρησιμοποιείται επίσης ως τροποποιητής δραστηριότητας με εμποτισμό σε αυτόκλειστο και επακόλουθη ακετυλίωση για την παραγωγή ισχυρού και ανθεκτικού ξύλου.
- Ο οξικός ανυδρίτης είναι η κύρια χημική ουσία που χρησιμοποιείται ως παράγοντας ακετυλίωσης στην παρασκευή παράνομων ναρκωτικών ηρωίνης και μεθακαλόνης.
Ανυδρίτες οργανικών οξέων
- Ένας ανυδρίτης οξέος που είναι οργανική χημική ουσία είναι γνωστός ως ανυδρίτης οργανικού οξέος. Ουσίες με δύο ομάδες ακυλίου συνδεδεμένες στο ίδιο άτομο οξυγόνου ονομάζονται ανυδρίτες οξέος. Οι καρβοξυλικοί ανυδρίτες του τύπου (RC(O)) 2 O είναι ένας τυπικός τύπος ανυδρίτη οργανικού οξέος στον οποίο το μητρικό οξύ είναι ένα καρβοξυλικό οξύ. Αυτή η μορφή συμμετρικού ανυδρίτη υποδηλώνεται με την αντικατάσταση της λέξης οξύ στο όνομα του μητρικού καρβοξυλικού οξέος με τη λέξη άνυδρο. Επομένως, το (CH3CO)2O ονομάζεται επίσης οξικός ανυδρίτης.
- Είναι γνωστοί μικτές (ή ασύμμετροι) ανυδρίτες οξέων στους οποίους υπάρχει αντίδραση μεταξύ δύο διαφορετικών καρβοξυλικών οξέων, όπως ο μυρμηκικός ανυδρίτης οξικό οξύ. Άλλες μορφές οργανικών οξέων, όπως σουλφονικά ή φωσφονικά οξέα, μπορούν επίσης να χρησιμεύσουν ως πηγή μιας ή και των δύο ακυλομάδων στον ανυδρίτη. Τα ανόργανα οξέα όπως το φωσφορικό οξύ χρησιμεύουν ως μία πηγή ακυλομάδων στους ανυδρίτες.
Βασικά σημεία που πρέπει να θυμάστε
- Οι ανυδρίτες οξέων χρησιμοποιούνται ευρέως στην οργανική χημεία.
- Πολλά προϊόντα παράγονται με τη βοήθειά τους:φαρμακευτικά προϊόντα, βιομηχανικά χημικά, εκρηκτικά, αρώματα.
- Οι εστέρες παράγονται από ακετυλιωτικές αλκοόλες.
- Σύνθεση ασπιρίνης (ακετυλοσαλικυλικό οξύ).
- Η ηρωίνη παράγεται με την αποακετυλίωση της μορφίνης.




