Διαφορά μεταξύ καύσης και πυρόλυσης
Κύρια διαφορά – Καύση έναντι πυρόλυσης
Η καύση και η πυρόλυση είναι θερμοχημικές αντιδράσεις. Η καύση είναι μια εξώθερμη χημική αντίδραση. η καύση ενός καυσίμου μπορεί να σχηματίσει φως και θερμότητα ως μορφές ενέργειας. Η πυρόλυση είναι μια αντίδραση αποσύνθεσης. Εδώ, τα οργανικά υλικά αποσυντίθενται όταν παρέχονται με θερμότητα. Αν και και οι δύο αυτές διαδικασίες είναι θερμοχημικές αντιδράσεις, υπάρχουν διαφορές μεταξύ των δύο διεργασιών. Η κύρια διαφορά μεταξύ της καύσης και της πυρόλυσης είναι ότιη καύση πραγματοποιείται υπό την παρουσία οξυγόνου ενώ η πυρόλυση γίνεται υπό την απουσία (ή σχεδόν απουσία) οξυγόνου.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η Καύση
– Ορισμός, Πλήρης και Ατελής Καύση, Χρήσεις
2. Τι είναι η πυρόλυση
– Ορισμός, διαδικασία και χρήσεις
3. Ποια είναι η διαφορά μεταξύ καύσης και πυρόλυσης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:καύση, καύση, πλήρης καύση, αποσύνθεση, εξώθερμη αντίδραση, ατελής καύση, πυρόλυση, θερμοχημικές αντιδράσεις

Τι είναι η Καύση
Η καύση είναι μια χημική αντίδραση που περιλαμβάνει την αντίδραση μεταξύ ουσιών και οξυγόνου, παράγοντας φως και θερμότητα ως μορφές ενέργειας. Αυτή η διαδικασία ονομάζεται επίσης καύση. Η θερμότητα και το φως είναι οι μορφές ενέργειας που δίνονται ως αποτέλεσμα της αντίδρασης. Η φωτεινή ενέργεια εμφανίζεται ως φλόγα. Ωστόσο, το μεγαλύτερο μέρος της ενέργειας απελευθερώνεται ως θερμική ενέργεια.
Η αντίδραση καύσης μπορεί να βρεθεί σε δύο τύπους, την πλήρη και την ημιτελή καύση.
Πλήρης καύση
Η πλήρης καύση λαμβάνει χώρα όταν υπάρχει περίσσεια οξυγόνου για την αντίδραση. Αυτό δίνει έναν περιορισμένο αριθμό προϊόντων. Όταν καίγεται καύσιμο, δίνει διοξείδιο του άνθρακα και νερό ως τελικά προϊόντα. Όταν ένα στοιχείο καίγεται, δίνει το πιο σταθερό οξείδιο αυτού του στοιχείου.
Ημιτελής καύση
Η ατελής καύση λαμβάνει χώρα παρουσία χαμηλής ποσότητας οξυγόνου. Αυτό δίνει περισσότερα προϊόντα στο τέλος. Όταν τα καύσιμα υποβάλλονται σε ατελή καύση, δίνουν μονοξείδιο του άνθρακα μαζί με διοξείδιο του άνθρακα και νερό. Μερικές φορές, ακόμη και άκαυστο στοιχείο άνθρακα παράγεται επίσης. Εδώ, ο άνθρακας απελευθερώνεται ως αιθάλη.

Εικόνα 1:Η φωτιά είναι αποτέλεσμα της καύσης
Υπάρχουν πολλές χρήσεις της αντίδρασης καύσης. Μια σημαντική χρήση είναι η παραγωγή ενέργειας με την καύση καυσίμων. Αυτό είναι σημαντικό σε βιομηχανίες, αυτοκίνητα, κ.λπ. Η παραγωγή φωτιάς είναι μια άλλη χρήση. Η φωτιά χρησιμοποιείται για πολλές ανάγκες όπως το μαγείρεμα. Μερικές φορές, η καύση στοιχείων χρησιμοποιείται για την αναγνώριση στοιχείων. Διαφορετικά στοιχεία δίνουν διαφορετικού χρώματος φλόγες όταν καίγονται. Παρατηρώντας αυτές τις φλόγες, μπορούμε να αναγνωρίσουμε διαφορετικά στοιχεία.
Τι είναι η πυρόλυση
Η πυρόλυση είναι η χημική αποσύνθεση οργανικών υλικών απουσία οξυγόνου. Αυτή η διαδικασία απαιτεί την εφαρμογή θερμότητας. Επομένως, ο ρυθμός πυρόλυσης μπορεί να αυξηθεί αυξάνοντας τη θερμοκρασία.
Η πυρόλυση λαμβάνει χώρα συνήθως σε θερμοκρασίες πάνω από 430C. Ωστόσο, δεδομένου ότι είναι πολύ δύσκολο να ληφθεί μια ατμόσφαιρα χωρίς οξυγόνο για πυρόλυση, γίνεται υπό συνθήκες σχεδόν απουσίας οξυγόνου. Η πυρόλυση δίνει τελικά προϊόντα σε αέρια φάση, υγρή φάση και στερεή φάση. Οι περισσότερες ουσίες μετατρέπονται σε αέρια. Μερικές φορές σχηματίζεται λίγη ποσότητα υγρού. Αυτό το υγρό ονομάζεται πίσσα. Το στερεό υπόλειμμα περιλαμβάνει συνήθως άνθρακα και βιοξυλάνθρακα.
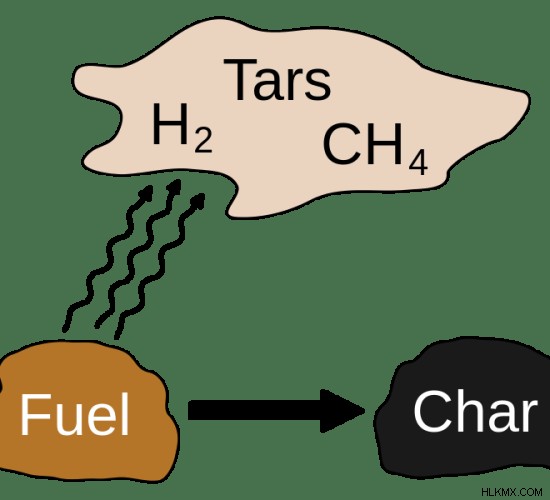
Εικόνα 2:Προϊόντα πυρόλυσης
Η διαδικασία της πυρόλυσης μετατρέπει το οργανικό υλικό στα αέρια συστατικά τους, ένα στερεό υπόλειμμα άνθρακα και τέφρας και ένα υγρό που ονομάζεται πυρολυτικό λάδι. Στην πυρόλυση, υπάρχουν δύο μέθοδοι που χρησιμοποιούνται για την απομάκρυνση τυχόν ρύπων από μια ουσία. Είναι η καταστροφή και η απομάκρυνση. Κατά την καταστροφή, οι ρύποι διασπώνται σε μικρότερες ενώσεις. Αλλά κατά τη διαδικασία απομάκρυνσης, αντί να σπάσουν οι ενώσεις, διαχωρίζονται οι ρύποι.
Η πυρόλυση είναι χρήσιμη σε βιομηχανίες για την παραγωγή άνθρακα, ενεργού άνθρακα, μεθανόλης κ.λπ. Εκτός από αυτό, η πυρόλυση αντιμετωπίζει και καταστρέφει ημιπτητικές οργανικές ενώσεις, καύσιμα και φυτοφάρμακα σε έδαφος. Αυτή η διαδικασία μπορεί επίσης να χρησιμοποιηθεί για την επεξεργασία οργανικών απορριμμάτων που προέρχονται από εργοστάσια.
Διαφορά μεταξύ της καύσης και της πυρόλυσης
Ορισμός
Κύση: Η καύση είναι μια χημική αντίδραση που περιλαμβάνει την αντίδραση μεταξύ ουσιών και οξυγόνου που παράγει φως και θερμότητα ως μορφές ενέργειας.
Πυρόλυση: Η πυρόλυση είναι η χημική αποσύνθεση οργανικών υλικών απουσία οξυγόνου.
Ατμόσφαιρα
Κύση: Η καύση πραγματοποιείται υπό την παρουσία οξυγόνου στην ατμόσφαιρα.
Πυρόλυση: Η πυρόλυση γίνεται με απουσία οξυγόνου.
Τελικά προϊόντα
Κύση: Η καύση παράγει αέρια τελικά προϊόντα.
Πυρόλυση: Η πυρόλυση παράγει αέρια συστατικά μαζί με ίχνη υγρών και στερεών υπολειμμάτων.
Τύποι
Κύση: Η καύση μπορεί να συμβεί ως πλήρης ή ατελής καύση.
Πυρόλυση: Η πυρόλυση μπορεί να γίνει σε κενό ή σε ατμόσφαιρα με σχεδόν απουσία οξυγόνου.
Συμπέρασμα
Η καύση και η πυρόλυση είναι θερμοχημικές αντιδράσεις. Αυτές οι αντιδράσεις χρησιμοποιούνται σε βιομηχανίες και καθημερινές ανάγκες. Αυτές οι διαδικασίες διαφέρουν μεταξύ τους σε πολλούς παράγοντες. Ωστόσο, η κύρια διαφορά μεταξύ της καύσης και της πυρόλυσης είναι ότι η καύση πραγματοποιείται υπό την παρουσία οξυγόνου ενώ η πυρόλυση πραγματοποιείται υπό απουσία (ή σχεδόν απουσία) οξυγόνου.




