Ανθρακικό νάτριο – Σύνθεση, Χρήσεις, Δομή, Φόρμουλα &Ιδιότητες
Γενικά, οι μαθητές μπερδεύονται μεταξύ της μαγειρικής σόδας και της σόδας πλυσίματος. Αυτά είναι τα κοινά ονόματα δύο διαφορετικών χημικών ενώσεων. Το ένα είναι ανθρακικό νάτριο, ενώ το άλλο είναι όξινο ανθρακικό νάτριο.
Τώρα, ποια είναι το ανθρακικό νάτριο, η μαγειρική σόδα ή η σόδα πλυσίματος; Μπορείτε να απαντήσετε σε αυτό; Ή μήπως μπερδεύεσαι κι εσύ ανάμεσά τους; Ποια είναι η φόρμουλα ανθρακικού νατρίου; Ποια είναι η φόρμουλα όξινου ανθρακικού νατρίου;
Αυτή η ενότητα αφορά το ανθρακικό νάτριο και τις ιδιότητες και τις χρήσεις του.
Τι είναι το ανθρακικό νάτριο;
Το ανθρακικό νάτριο είναι ένα εγκεκριμένο από τον FDA πρόσθετο τροφίμων. Μερικές φορές ονομάζεται ανθρακική σόδα, σόδα πλυσίματος, ανθρακικό δινάτριο ή κρύσταλλοι σόδας. Το ανθρακικό νάτριο, ή ανθρακικό νάτριο, είναι ένα κοινό συστατικό σε πολλές διαδικασίες παραγωγής.
Το ανθρακικό νάτριο είναι μια φυσική ένωση που μπορεί επίσης να κατασκευαστεί τεχνητά. Το ανθρακικό νάτριο είναι εύκολα διαθέσιμο σε παντοπωλεία, καταστήματα ειδών πισίνας και καταστήματα υλικού.
Το ανθρακικό νάτριο είναι μια ανόργανη ένωση που χρησιμοποιείται ως μέτρια ισχυρή βάση. Αποτελεί βασικό συστατικό των σαπουνιών πλυντηρίου και πολλών άλλων οικιακών προϊόντων.
Τύπος και δομή ανθρακικού νατρίου
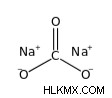
Ο τύπος ανθρακικού νατρίου Na2CO3 είναι το δινάτριο άλας του ανθρακικού οξέος. Η μοριακή μάζα ανθρακικού νατρίου είναι 106,0 g/mol. Είναι μια ιοντική ένωση. Περιλαμβάνει ένα ανθρακικό ανιόν (CO3-) και δύο κατιόντα νατρίου (Na+). Έχει κρυσταλλική δεκαϋδρική δομή.
Η δομή του ανθρακικού νατρίου δίνεται παρακάτω:
Υδρίτες ανθρακικού νατρίου
Συνήθως, το ανθρακικό νάτριο υπάρχει σε τρεις ένυδρες ενώσεις και σε κατάσταση άνυδρου άλατος. Αυτές οι καταστάσεις είναι
1. Natron:
Είναι δεκαϋδρικό ανθρακικό νάτριο. Ο χημικός τύπος του είναι Na2CO3·10H2O. Κρυσταλλώνεται εύκολα για να σχηματίσει μονοένυδρο.
2. Θερμονατρίτης:
Είναι ένα μονοένυδρο ανθρακικό νάτριο. Ο χημικός του τύπος είναι Na2CO3·H2O. Ονομάζεται επίσης ανθρακικό κρύσταλλο.
3. Επταένυδρο ανθρακικό νάτριο:
Δεν είναι γνωστό σε ορυκτή μορφή. Ο χημικός τύπος του είναι Na2CO3·7H2O.
4. Νατρικό:
Είναι άνυδρο ανθρακικό νάτριο και ονομάζεται επίσης πυρωμένη σόδα. Κατά τη θέρμανση ένυδρων, σχηματίζεται. Ένας άλλος τρόπος λήψης νατρικών αλάτων είναι με θέρμανση όξινου ανθρακικού νατρίου.
Σύνθεση ανθρακικού νατρίου
Υπάρχουν πέντε διαδικασίες για τη σύνθεση ανθρακικού νατρίου, δηλαδή, εξόρυξη, Barilla και φύκια, Leblanc, Hou's και διαδικασία Solvay.
Μεταξύ αυτών των πέντε τρόπων, η διαδικασία Solvay είναι η πιο εμπορικά χρησιμοποιούμενη διαδικασία για τη σύνθεση ανθρακικού νατρίου.
Η διαδικασία Solvay:
Ένας βιομηχανικός χημικός, ο Ernest Solvay από τον Βέλγο, ανέπτυξε μια μέθοδο το 1861 για την παραγωγή ανθρακικού νατρίου. Τα βήματα που ακολουθούνται στη διαδικασία Solvay είναι
Βήμα 1:Παραγωγή όξινου ανθρακικού νατρίου:
Σε αυτό το βήμα, το όξινο ανθρακικό νάτριο και το χλωριούχο αμμώνιο παράγονται χρησιμοποιώντας αμμωνία, χλωριούχο νάτριο και νερό. Η χημική αντίδραση που λαμβάνει χώρα ήταν
NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl
Βήμα 2:Παραγωγή ανθρακικού νατρίου:
Σε αυτό το στάδιο, με θέρμανση του τύπου όξινου ανθρακικού νατρίου NaHC03 από το στάδιο 1, μετατρέπεται σε ανθρακικό νάτριο. Σε αυτό το βήμα απελευθερώνονται νερό και διοξείδιο του άνθρακα.
2NaHCO3 → Na2CO3 + H2O + CO2 ↑
Βήμα 3:Ανακύκλωση αμμωνίας:
Το χλωριούχο αμμώνιο που παράγεται στο στάδιο 1 υποβάλλεται σε επεξεργασία με ασβέστη και το προϊόν διοξειδίου του άνθρακα που έχει απομείνει βρίσκεται στο στάδιο 2. Η αντίδραση που λαμβάνει χώρα είναι
2NH4Cl + CaO → 2NH3 + CaCl2 + H2O
Η παραγόμενη αμμωνία ανακυκλώνεται με τη διαδικασία Solvay. Το μόνο απόβλητο προϊόν στη διαδικασία Solvay είναι το χλωριούχο ασβέστιο, ενώ η άλμη και ο ασβεστόλιθος είναι οι μόνες ουσίες που καταναλώνονται. Ως αποτέλεσμα, η διαδικασία γίνεται ουσιαστικά πιο οικονομική από την άλλη διαδικασία.
Φυσικές ιδιότητες του ανθρακικού νατρίου
Υπάρχει φυσικό καθώς και τεχνητό ανθρακικό νάτριο διαθέσιμο στο περιβάλλον. Φυσικά, εμφανίζεται σε άνυδρες περιοχές, ειδικά σε κοιτάσματα ορυκτών που βρίσκονται όταν εξατμίζεται περιοδικά το νερό της λίμνης.
Είναι κατασκευασμένο από Trona, ένα διάλυμα δύο αλάτων. Μερικές άλλες φυσικές ιδιότητες του ανθρακικού νατρίου είναι
- Είναι μια λευκή κρυσταλλική στερεή ουσία.
- Η μοριακή μάζα ανθρακικού νατρίου είναι 105,99 g/mol.
- Είναι άοσμο, άγευστο και εξαιρετικά διαλυτό στο νερό.
- Το σημείο βρασμού του Na2CO3 είναι 1600°C, ενώ αποσυντίθεται στους 851°C.
- Είναι βασικό ή αλκαλικό καθώς μετατρέπει την κόκκινη λακκούβα σε μπλε.
- Η πυκνότητα του ανθρακικού νατρίου είναι 2,54 g/cm³.
- Είναι ένα από τα λίγα υδατοδιαλυτά ανθρακικά μέταλλα.
- Μία από τις σπάνια εμφανιζόμενες μορφές του ονομάζεται νάτριο.
Χημικές ιδιότητες του ανθρακικού νατρίου
Μερικές κύριες χημικές ιδιότητες του ανθρακικού νατρίου είναι
1. Επίδραση θερμότητας:
Δεν υπάρχει επίδραση της θερμότητας στο άνυδρο ανθρακικό νάτριο. Λιώνει στους 852°C χωρίς να αποσυντίθεται.
2. Επίδραση της υδρόλυσης:
Κατά τη διάρκεια της υδρόλυσης, ιόντα ΟΗ- απελευθερώνονται στο διάλυμα. Αυτά τα ιόντα καθιστούν το διάλυμα ανθρακικού νατρίου ελαφρώς αλκαλικό.
Na2CO3 + 2H2O → H2CO3 + 2Na+ + 2OH-
3. Επίδραση του διοξειδίου του άνθρακα:
Το υδατικό ανθρακικό νάτριο απορροφά διοξείδιο του άνθρακα και παράγει όξινο ανθρακικό νάτριο.
Na2CO3 + H2O + CO2 → 2NaHCO3
4.Επίδραση φυτικών οξέων:
Όταν ήπια οξέα όπως ο χυμός λάιμ αντιδρούν με ανθρακικό νάτριο, σχηματίζεται διοξείδιο του άνθρακα.
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
- Έχει απορρυπαντικές ιδιότητες μέσω της σαπωνοποίησης, που κάνει τα λίπη και τα λίπη αναμίξιμα με το νερό.
Χρήσεις ανθρακικού νατρίου
1. Αποσκλήρυνση νερού:
Το ανθρακικό νάτριο βοηθά να μαλακώσει το νερό αφαιρώντας Ca2+, Mg2+ και άλλα ιόντα που το κάνουν σκληρό νερό. Όταν όλα αυτά τα ιόντα υποβάλλονται σε επεξεργασία με ανθρακικά ιόντα, σχηματίζουν αδιάλυτα στερεά ιζήματα. Επιπλέον, το μαλακό νερό έχει πολλά οφέλη. Μειώνει τη σπατάλη σαπουνιού, αυξάνει τη διάρκεια ζωής των σωλήνων και των εξαρτημάτων και τα προστατεύει από τη σκουριά.
2. Κατασκευή γυαλιού:
Το ανθρακικό νάτριο και η καυστική σόδα απαιτούνται για την κατασκευή γυαλιού. Το ανθρακικό νάτριο, Na2CO3, χρησιμεύει ως ροή πυριτίου. Μειώνει το σημείο τήξης του μείγματος χωρίς ειδικά υλικά και επιτυγχάνει φθηνά «γυαλί σόδα-λάιμ».
3. Πρόσθετα τροφίμων και μαγείρεμα:
Το ανθρακικό νάτριο είναι ένα πρόσθετο τροφίμων που δρα ως αντισυσσωματικός παράγοντας, ρυθμιστής οξύτητας, σταθεροποιητής και ανυψωτικός παράγοντας. Έχει μια ποικιλία γαστρονομικών εφαρμογών. Προστίθεται επίσης σε ορισμένα τρόφιμα για να βελτιώσει τη γεύση τους.
4. Μερικές άλλες χρήσεις:
Χρησιμοποιείται στη βιομηχανία τούβλων ως διαβρεκτικός παράγοντας για τη μείωση της ποσότητας νερού που απαιτείται για την εξώθηση του πηλού. Πολλές σκόνες ξηρού σαπουνιού περιέχουν Na2CO3. Επιπλέον, δρα ως παράγοντας αφρού και λειαντικό στην οδοντόκρεμα. Χρησιμοποιείται επίσης ως ισχυρή βάση σε διάφορες εφαρμογές.
Σύνοψη
Τι είναι το ανθρακικό νάτριο; Εν ολίγοις, το ανθρακικό νάτριο είναι ένα δινάτριο άλας ανθρακικού οξέος με τον χημικό τύπο Na2CO3. Η μοριακή μάζα ανθρακικού νατρίου είναι 105,99 g/mol. Υπάρχουν δύο τρόποι για τη σύνθεση ανθρακικού νατρίου.
Είναι χρήσιμο για διάφορους σκοπούς στο σπίτι αλλά και εμπορικά. Χρησιμοποιείται για την παρασκευή σαπουνιού, γυαλιού και άλλων χημικών ουσιών. Λειτουργεί επίσης ως ρυθμιστής pH.
Αν και μια χαμηλή συγκέντρωση ανθρακικού νατρίου δεν μπορεί να βλάψει το δέρμα, μια υδατική μορφή ανθρακικού νατρίου είναι εξαιρετικά αντιδραστική και διαβρωτική. Μπορεί να προκαλέσει σημαντικό ερεθισμό του δέρματος και των ματιών. Επομένως, είναι απαραίτητο να το χειρίζεστε με προσοχή και ασφάλεια.
Συχνές ερωτήσεις
1. Ποια είναι τα συμπτώματα της δηλητηρίασης από ανθρακικό νάτριο;
Α. Αν και το ανθρακικό νάτριο είναι αβλαβές όταν λαμβάνεται σε μικρές ποσότητες, η υπερβολική ποσότητα μπορεί να προκαλέσει δηλητηρίαση. Μερικά συμπτώματα δηλητηρίασης από ανθρακικό νάτριο περιλαμβάνουν
- Προβλήματα αναπνοής
- Έμετος
- Διάρροια
- Χαμηλή αρτηριακή πίεση
- Ερεθισμός των ματιών
Επομένως, χειριστείτε το με προσοχή.
2. Είναι τοξικό το ανθρακικό νάτριο;
Α. Γενικά είναι ακίνδυνο όταν έρχεται σε επαφή με το δέρμα. Ωστόσο, διαλύματα που παρασκευάζονται με ανθρακικό νάτριο μπορεί να είναι διαβρωτικά. Αν και μικρές ποσότητες δεν είναι τοξικές, η υπερβολική ποσότητα μπορεί να προκαλέσει δηλητηρίαση. Ωστόσο, ως επί το πλείστον, το ανθρακικό νάτριο έχει χαμηλό κίνδυνο τοξικότητας.
3. Τι συμβαίνει όταν το ανθρακικό νάτριο προσλαμβάνεται από το στόμα;
Α. Η κατάποση ανθρακικού νατρίου δεν θα πρόσθετε ένα φορτίο νατρίου στο σώμα σας. Ακόμη και η ποσότητα που προσλαμβάνετε είναι πολύ χαμηλότερη από την ποσότητα νατρίου στο φαγητό σας. Όταν καταναλώνετε ανθρακικό νάτριο από το στόμα, αναμειγνύεται με το νερό στο σώμα σας και δρα ως αντιόξινο. Θα εξουδετερώσει το γαστρικό οξύ στο στομάχι σας. Αλλά δεν συνταγογραφείται συνήθως για αυτό το σκοπό.
4. Πόσο ανθρακικό νάτριο πρέπει να προστεθεί στο πόσιμο νερό για να αποφευχθεί η διάβρωση;
Α. Το ανθρακικό νάτριο προστίθεται συχνά στο νερό σε κάποια ποσότητα για να αλλάξει το pH και η αλκαλικότητά του. Κανονικά, προστίθεται στην περιοχή από 1 ppm έως 40 ppm κατά τη διαδικασία ελέγχου της διάβρωσης. Αυτή η ποσότητα είναι ασήμαντη σε σύγκριση με τη φυσική ποσότητα στα τρόφιμα και τα ποτά.
5. Ποια βήματα περιλαμβάνονται στη διαδικασία Leblanc για την παραγωγή ανθρακικού νατρίου;
Α. Σε αυτή τη διαδικασία παραγωγής, λαμβάνουν χώρα τρία βήματα. Αυτά είναι
Βήμα 1: Το χλωριούχο νάτριο επεξεργάζεται με θειικό οξύ.
2NaCl + H2SO4 → Na2SO4 + 2HCl
Βήμα 2: Το θειικό νάτριο θερμαίνεται με άνθρακα.
Na2SO4 + 2C → Na2S + 2CO2
Βήμα 3: Θειούχο νάτριο και ανθρακικό ασβέστιο υποβάλλονται σε επεξεργασία σε αυτό το τελικό στάδιο.
Na2S + CaCO3 → Na2CO3 + CaS
6. Ποια είναι τα υλικά που εμπλέκονται στη διαδικασία Solvay;
Α. Τα κύρια υλικά που χρησιμοποιούνται στη διαδικασία Solvay είναι φθηνά και εύκολα διαθέσιμα. Είναι
- Αλατόνερο ή διάλυμα χλωριούχου νατρίου:
Το NaCl παρέχει ιόντα Na+ κατά την παραγωγή ανθρακικού νατρίου. Η άλμη είναι διαθέσιμη σε αφθονία στη γη. Μπορεί να συλλεχθεί εύκολα τόσο από τον ωκεανό όσο και από την ενδοχώρα.
- Ασβεστόλιθος ή ανθρακικό ασβέστιο:
Το CaCO3 παρέχει ιόντα CO3- στην παραγωγή Na2CO3. Είναι άμεσα διαθέσιμο από την εξόρυξη.
- Αμμωνία:
Το NH3 παρασκευάζεται βιομηχανικά με τη διαδικασία του Haber. Είναι ακριβό, αλλά μπορεί να ανακυκλωθεί στη διαδικασία Solvay.




