Τι είναι η Διαλυτότητα;
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μυηθείτε στις ιδιότητες της διαλυτότητας και τους διάφορους παράγοντες που το επηρεάζουν. Θα γνωρίσετε επίσης διαλυμένες ουσίες, διαλύτες και διαλύματα.
Θέματα που καλύπτονται σε άλλα άρθρα
- KSP- Σταθερά προϊόντος διαλυτότητας
- Τι είναι ο πολικός ομοιοπολικός δεσμός
- Διαμοριακές δυνάμεις
- Τι είναι η σταθερά ισορροπίας
- Τι είναι ο διαλύτης
Λεξιλόγιο
- Διάλυμα – είναι η ουσία που διαλύεται σε έναν διαλύτη για να σχηματίσει ένα ομοιογενές μείγμα.
- Διαλύτης – είναι η ουσία που χρησιμοποιείται για τη διάλυση των διαλυμένων ουσιών. Αυτή είναι συνήθως η ουσία σε μεγαλύτερη ποσότητα.
- Λύση – ένα ομοιογενές μείγμα μιας ή περισσότερων διαλυμένων ουσιών.
Κατανόηση λύσεων
Για να κατανοήσουμε τη διαλυτότητα πρώτα πρέπει να καταλάβουμε τι συνθέτει μια λύση. Τα διαλύματα αποτελούνται από μια διαλυμένη ουσία και έναν διαλύτη. Για να κατανοήσετε τη διαφορά μεταξύ των δύο ανατρέξτε στο παράδειγμα του αλμυρού νερού. Το νερό είναι ο διαλύτης επειδή αυτή είναι η ουσία που χρησιμοποιείται για τη διάλυση της διαλυμένης ουσίας. Το αλάτι είναι η διαλυμένη ουσία γιατί είναι η ουσία που διαλύεται στο νερό. Οι διαλύτες είναι συνήθως πιο άφθονοι στο διάλυμα. Τα διαλύματα μπορούν να βρεθούν σε οποιεσδήποτε μορφές των τριών καταστάσεων της ύλης, αυτό σημαίνει ότι δεν είναι όλα τα διαλύματα υγρά, ο χάλυβας είναι ένα διάλυμα.
Για να θεωρηθεί κάτι ως διάλυμα, πρέπει να ληφθούν υπόψη οι αναλογίες των διαφορετικών συστατικών (η διαλυμένη ουσία και ο διαλύτης). Στην παρακάτω φωτογραφία ένα φλιτζάνι είναι γεμάτο με ζάχαρη, ένα άλλο με αλάτι και το τελευταίο με λάσπη. Το φλιτζάνι γεμάτο με λάσπη διακρίνεται πολύ από τα φλιτζάνια με αλάτι και ζάχαρη. Αυτό συμβαίνει γιατί το κύπελλο γεμάτο με λάσπη είναι ένα ετερογενές μείγμα και όχι μια λύση. Όλα τα διαλύματα είναι ομοιογενή, που σημαίνει ότι οι συνθέσεις είναι ομοιόμορφες παντού.
.

Διαλυτότητα
Διαλυτότητα είναι η ικανότητα μιας διαλυμένης ουσίας να διαλύεται σε έναν διαλύτη για να σχηματίσει ένα διάλυμα. Αυτή είναι η ιδιότητα που επιτρέπει σε πράγματα όπως τα μόρια ζάχαρης να διαλυθούν σε ένα φλιτζάνι καφέ. Το νερό είναι γνωστό ως «καθολικός διαλύτης» επειδή μπορεί να διαλύσει τις περισσότερες ουσίες, αλλά υπάρχουν μερικές εξαιρέσεις.
Η διαλυτότητα σχηματίζει νέους δεσμούς μεταξύ των μορίων της διαλυμένης ουσίας και των μορίων του διαλύτη. Αυτή είναι η μέγιστη συγκέντρωση διαλυμένης ουσίας που διαλύεται σε μια γνωστή συγκέντρωση διαλύτη σε μια δεδομένη θερμοκρασία. Οι διαλυμένες ουσίες κατηγοριοποιούνται σε τρεις κατηγορίες:πολύ διαλυτές, ελάχιστα διαλυτές ή αδιάλυτες. Για να θεωρηθεί διαλυτή μια συγκέντρωση 0,1 g ή περισσότερο μιας διαλυμένης ουσίας μπορεί να διαλυθεί σε 100 ml διαλύτη. Εάν μια συγκέντρωση κάτω από 0,1 g διαλύεται στον διαλύτη, λέγεται ότι είναι αραιοδιαλυτός. Η διαλυτότητα μπορεί να εκφραστεί ως ο αριθμός των γραμμαρίων διαλυμένης ουσίας σε ένα λίτρο κορεσμένου διαλύματος. Για παράδειγμα, η διαλυτότητα στο νερό μπορεί να εμφανίζεται ως 12 g/L στους 25 C. Μοριακή διαλυτότητα είναι ο αριθμός γραμμομορίων διαλυμένης ουσίας ανά λίτρο κορεσμένου διαλύματος. Για παράδειγμα, 0,115 mol/L στους 25 C.
Παράγοντες που επηρεάζουν τη διαλυτότητα
Θερμοκρασία
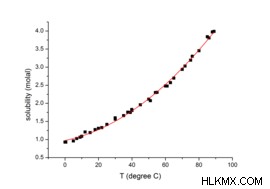
Ένας από τους παράγοντες που μπορεί να επηρεάσει τη διαλυτότητα μιας διαλυμένης ουσίας είναι η διακύμανση της θερμοκρασίας. Αν αλλάξει η θερμοκρασία μπορούμε να αυξήσουμε τη διαλυτότητα μιας ουσίας. Ένα ελάχιστα στερεό-υγρό μπορεί να διαλυθεί πλήρως αυξάνοντας τη θερμοκρασία καθιστώντας αυτή την ουσία διαλυτή στη δεδομένη θερμοκρασία. Για παράδειγμα, η ζάχαρη μπορεί να είναι πιο διαλυτή στο νερό σε υψηλότερες θερμοκρασίες. Στην περίπτωση μιας ουσίας σε αέρια κατάσταση, η θερμοκρασία θα έχει το αντίστροφο αποτέλεσμα. Έτσι, όσο αυξάνεται η θερμοκρασία, η διαλυτότητα ενός αερίου σε ένα υγρό μειώνεται.
Δεσμοί και μεταβαλλόμενες δυνάμεις
Οι δυνάμεις και οι δεσμοί μπορεί επίσης να επηρεάσουν τη διαλυτότητα μιας ουσίας. Ο τύπος των δεσμών και οι διαμοριακές δυνάμεις διαφέρουν μεταξύ κάθε ουσίας και των μορίων της. Ο όρος "όπως διαλύει όπως", μπορεί να χρησιμοποιηθεί για να περιγράψει πολικούς διαλύτες που διαλύουν πολικές διαλυμένες ουσίες και μη πολικούς διαλύτες που διαλύουν μη πολικές διαλυμένες ουσίες. Για παράδειγμα, δεδομένου ότι το νερό είναι ένας πολικός διαλύτης, μπορεί να χρησιμοποιηθεί για τη διάλυση του υδροχλωρικού οξέος, καθώς είναι ένα πολικό μόριο. Επομένως, όσο ισχυρότερες είναι οι διαμοριακές δυνάμεις μεταξύ των μορίων της διαλυμένης ουσίας και των μορίων του διαλύτη τόσο μεγαλύτερη είναι η διαλυτότητα της διαλυμένης ουσίας στον διαλύτη.
Πίεση
Η πίεση μπορεί να επηρεάσει τη διαλυτότητα με διάφορους τρόπους. Όσον αφορά την πίεση, τα αέρια επηρεάζονται πολύ περισσότερο από τα υγρά. Η πίεση και η διαλυτότητα σχετίζονται άμεσα, οπότε όταν αυξάνεται η μερική πίεση αυξάνεται και η διαλυτότητα. Όταν η πίεση μειώνεται το ίδιο συμβαίνει και για τη διαλυτότητα. Για παράδειγμα, το νερό σε θερμοκρασία δωματίου έχει ήδη διαλύσει μόρια αερίου. Όταν το νερό βράσει, το αέριο διαφεύγει με τη μορφή φυσαλίδων, μειώνοντας έτσι τη διαλυτότητα του αερίου.
Διαλυτότητα στερεών σε υγρά
Μπορεί να συναχθεί ότι η διαλυτότητα ενός στερεού εξαρτάται από τους παράγοντες της διαλυμένης ουσίας και του διαλύτη. Λόγω των ποικίλων διαμοριακών δυνάμεων σε μια ουσία, έχει παρατηρηθεί ότι μόνο οι πολικές διαλυμένες ουσίες τείνουν να διαλύονται στον πολικό διαλύτη και οι μη πολικοί διαλύτες διαλύουν μόνο τις μη πολικές διαλυμένες ουσίες.
Αφού μια στερεή διαλυμένη ουσία τοποθετηθεί σε έναν διαλύτη, τα σωματίδια της διαλυμένης ουσίας διαλύονται στον διαλύτη, γνωστή και ως διάλυση. Σε αυτό το σημείο, επιτυγχάνεται δυναμική ισορροπία. Ο αριθμός των μορίων της διαλυμένης ουσίας στο διάλυμα θα είναι ίσος με τον αριθμό των σωματιδίων που ξεπλένονται από το διάλυμα. Η συγκέντρωση της διαλυμένης ουσίας στο διάλυμα θα παραμείνει σταθερή σε μια δεδομένη θερμοκρασία και πίεση. Όταν δεν μπορεί να διαλυθεί άλλη διαλυμένη ουσία σε διαλύτη, το διάλυμα θεωρείται κορεσμένο. Αυτό συμβαίνει όταν η μοριακότητα (Μ) και η διαλυτότητα συνδέονται άμεσα. Η μοριακότητα της διαλυμένης ουσίας είναι ίση με τη διαλυτότητά της. Η συγκέντρωση της διαλυμένης ουσίας σε ένα τέτοιο διάλυμα ονομάζεται διαλυτότητά της στη δεδομένη θερμοκρασία και πίεση. Όταν δεν μπορεί να προστεθεί άλλη διαλυμένη ουσία στο διάλυμα, τότε το διάλυμα είναι ακόρεστο.




