Αμμωνία :Δομή, Ιδιότητες, Χρήσεις &Εμφάνιση
Μπορείτε να πείτε ποιο είναι το πιο άφθονο αέριο στην ατμόσφαιρα; Αζωτο? Ναί! Το άζωτο είναι το πιο άφθονο αέριο στην ατμόσφαιρα. Αποτελεί περίπου το 78% του όγκου στην ατμόσφαιρα.
Το άζωτο εμφανίζεται στη διατομική, δηλ., μορφή δινιτρογόνου ή N2. Έχετε διαβάσει τον περιοδικό πίνακα και παρατηρήσατε ότι το όνομα γνωρίζει γενικά τις περισσότερες ομάδες του πρώτου τους μέλους. Λοιπόν, μπορείτε να μαντέψετε το όνομα της ομάδας που περιέχει αέριο άζωτο; Τι συμβαίνει όταν το άζωτο αντιδρά με το υδρογόνο; Πώς ονομάζεται το προϊόν που σχηματίζεται με αυτόν τον τρόπο; Τι είναι η αμμωνία; Ποιες είναι οι ιδιότητές του;
Αυτή η ενότητα θα σας βοηθήσει να μάθετε περισσότερα για την αμμωνία, ένα προϊόν που σχηματίζεται από την αντίδραση αζώτου και υδρογόνου.
Τι είναι η αμμωνία;
Λόγω της ηλεκτραρνητικότητας και του μικρού μεγέθους του αζώτου, μπορεί να σχηματίσει πολλές ενώσεις με άλλα στοιχεία του περιοδικού πίνακα. Η αμμωνία είναι ένα από αυτά. Έχει τις δικές του μοναδικές ιδιότητες και χρήσεις.
Τι είναι η αμμωνία; Η αμμωνία είναι το προϊόν ή η ένωση που σχηματίζεται από τη σύνδεση ή την αντίδραση μεταξύ αζώτου και υδρογόνου. Είναι μια από τις απλούστερες ενώσεις που σχηματίζονται από αυτά τα δύο στοιχεία. Ο τύπος μοριακής αμμωνίας είναι NH3.
Διατίθεται σε μικρές ποσότητες στο έδαφος και στον αέρα. Στο έδαφος, σχηματίζεται με την αποσύνθεση αζωτούχων οργανικών πραγμάτων, δηλαδή ουρίας. Η αμμωνία έχει πολλές περιβαλλοντικές και βιομηχανικές χρήσεις. Είναι το δομικό στοιχείο πολλών φαρμάκων και προϊόντων καθαρισμού.
Δομή της αμμωνίας
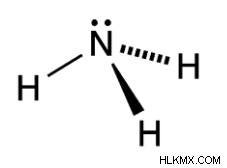
Σύμφωνα με τη δομή Lewis, το άτομο αζώτου περιβάλλεται από τέσσερα ζεύγη ηλεκτρονίων. Αυτά τα τέσσερα ζεύγη ηλεκτρονίων περιλαμβάνουν τρία ζεύγη δεσμών με τρία άτομα Η και ένα μεμονωμένο ζεύγος ένα άτομο Ν. Ως αποτέλεσμα, σχηματίζουν τη χωρική διάταξη αυτών των τεσσάρων ζευγών ηλεκτρονίων γύρω από το τετράεδρο του ατόμου Ν.
Λόγω ενός μοναχικού ζεύγους σε μία από τις τέσσερις κορυφές του τετραέδρου, εμφανίζεται μια απώθηση ζεύγους μοναχικού ζεύγους-δεσμού. Δεδομένου ότι αυτή η απώθηση είναι μεγαλύτερη από την απώθηση ζεύγους δεσμού-δεσμού, η γωνία δεσμού της αμμωνίας μειώνεται από 109,5° σε 107,5°. Επομένως, το σχήμα του μορίου του τύπου αμμωνίας NH3 δεν είναι τετραεδρικό, αλλά παραμορφώνεται και γίνεται τριγωνικό πυραμιδικό.
Παρασκευή αμμωνίας
Υπάρχουν δύο τρόποι παρασκευής αμμωνίας, δηλαδή εργαστηριακός και εμπορικός.
1. Εργαστηριακή μέθοδος:
- Με θέρμανση θειικού αμμωνίου και υδροξειδίου του νατρίου (ή άλλων ισχυρών βάσεων).
(NH4)2SO4 + 2NaOH + Θερμότητα → 2NH3 + 2H2O + Na2SO4
- Με θέρμανση σβησμένου ασβέστη και χλωριούχου αμμωνίου.
2NH4Cl + Ca(OH)2 + Θερμότητα → 2NH3 + 2H2O + CaCl2
- Όταν το νερό αντιδρά με νιτρίδια μετάλλων.
Mg3N2 + 6H2O → 3Mg(OH)2 +2NH3
2. Εμπορική μέθοδος:
Σε βιομηχανική κλίμακα, η αμμωνία παράγεται με τη διαδικασία του Haber.
N2 (g) + 3H2 (g) ⇌ 2NH3 (g)
Αυτή η αντίδραση είναι εφικτή σε χαμηλή θερμοκρασία, υψηλή πίεση και παρουσία καταλύτη.
Φυσικές ιδιότητες της αμμωνίας
- Είναι ένα άχρωμο αέριο με προβλέψιμη έντονη μυρωδιά.
- Προκαλεί δάκρυα στα μάτια.
- Ο τύπος αμμωνίας είναι NH3.
- Η μοριακή μάζα αμμωνίας είναι 17.031 g/mol.
- Η πυκνότητα της αμμωνίας είναι 0,68 g/cm³. Ως εκ τούτου, είναι ελαφρύτερο από τον αέρα.
- Είναι εξαιρετικά διαλυτό στο νερό.
- Η υγρή αμμωνία βράζει στους 239,6 Κ, ενώ το σημείο τήξεώς της είναι 198,4 Κ.
- Ρευστοποιείται εύκολα με ψύξη υπό πίεση.
- Ρευστοποιείται εύκολα με ψύξη υπό πίεση.
- Όταν εξατμίζεται, η υγρή αμμωνία προκαλεί έντονη ψύξη.’
Χημικές ιδιότητες της αμμωνίας
- Έχει βασική φύση. Ωστόσο, αυτή η βασική φύση είναι πολύ αδύναμη, αλλά οφείλεται στον σχηματισμό ιόντων ΟΗ-.
- Αντιδρά με διαλύματα αλάτων βαρέων μετάλλων και σχηματίζει τα ιζήματα υδροξειδίου τους.
FeCl3 + 3NH4OH → Fe(OH)3 ↓ + 3NH4Cl
- Συμπεριφέρεται ως βάση Lewis.
NH3 + BF3 → H3N→BF3
- Οξειδώνεται σε άζωτο όταν περνά μέσα από βρωμιούχο νερό.
8NH3 + 3Br2 → N2 + 6NH4Br
- Με το υποχλωριώδες νάτριο, οξειδώνεται και σχηματίζει υδραζίνη.
2NH3 + NaOCl → NH2.NH2 + NaCl + H2O
- Η υγρή αμμωνία δρα ως διαλύτης σε πολλές χημικές αντιδράσεις.
2NH3 ⇌ NH4⁺ + NH2-
- Σχηματίζει αμίδια και απελευθερώνει αέριο υδρογόνο όταν περνά πάνω από λιωμένα μέταλλα όπως το νάτριο ή το κάλιο.
2Na + 2NH3 → 2NaNH2 + N2
- Λόγω της υψηλής ηλεκτραρνητικότητας του αζώτου, ο δεσμός Ν-Η είναι αρκετά πολικός. Ως εκ τούτου, το μόριο του τύπου αμμωνίας NH3 υφίσταται διαμοριακό δεσμό Η.
Χρήσεις αμμωνίας
Η αμμωνία έχει διάφορες χρήσεις. Μερικά από αυτά είναι
- Στη διαδικασία Solvay, η αμμωνία χρησιμοποιείται για την παραγωγή ανθρακικού νατρίου.
- Στη διαδικασία του Ostwald, χρησιμοποιείται η μέθοδος παραγωγής νιτρικού οξέος, NH3.
- Η αμμωνία χρησιμοποιείται στην παραγωγή λιπασμάτων όπως νιτρικό αμμώνιο, θειικό αμμώνιο, φωσφορικό διαμμώνιο, ουρία κ.λπ.
- Χρησιμοποιείται στην παρασκευή ρεγιόν και ουρίας.
- Η αμμωνία χρησιμοποιείται ως καθαριστικό για την αφαίρεση λίπους κ.λπ. από γυάλινες επιφάνειες και έπιπλα.
- Η αμμωνία χρησιμοποιείται ως ψυκτικό σε φυτά πάγου.
- Είναι ένα σημαντικό αντιδραστήριο και χρησιμοποιείται ως διαλύτης στο εργαστήριο.
- Η οικιακή αμμωνία, δηλαδή το υδροξείδιο του αμμωνίου, χρησιμοποιείται για τον καθαρισμό διαφόρων επιφανειών.
- Βοηθά στη διάσπαση της οικιακής βρωμιάς ή των λεκέδων από ζωικά λίπη ή φυτικά έλαια.
- Η αμμωνία χρησιμοποιείται για τον καθαρισμό των αποθεμάτων νερού.
- Λειτουργεί ως δομικό στοιχείο για την παραγωγή εκρηκτικών, πλαστικών, φυτοφαρμάκων, υφασμάτων και βαφών.
Πώς να δοκιμάσετε την αμμωνία;
Είτε μια αντίδραση απελευθερώνει αμμωνία είτε η ένωση σας δίνεται είναι αμμωνία είτε όχι, πρέπει να κάνετε κάποια δοκιμή για να το επαληθεύσετε. Ορισμένες εξετάσεις που μπορούν να σας βοηθήσουν στον εντοπισμό της παρουσίας αμμωνίας είναι
1. Δοκιμή λυχνίας:
Καθώς η αμμωνία έχει μια βασική φύση, μετατρέπει το υγρό κόκκινο χαρτί λακκούβας σε μπλε.
2. Χαρτί κουρκουμά:
Λόγω του βασικού της χαρακτήρα, η αμμωνία μετατρέπει το κίτρινο χαρτί κουρκουμά σε καφέ.
3. Δοκιμή με πυκνό υδροχλωρικό οξύ:
Μια σταγόνα πυκνού υδροχλωρικού οξέος (HCl) παράγει πυκνούς λευκούς ατμούς NH4Cl, δηλαδή χλωριούχο αμμώνιο.
4. Με χλωροπλατινικό οξύ:
Όταν η αμμωνία υποβάλλεται σε επεξεργασία με χλωροπλατινικό οξύ, δίνει ένα κίτρινο ίζημα.
H2PtCl6 + 2NH3 → (NH4)₂PtCl6
5. Με το αντιδραστήριο Nessler:
Δίνει ένα καφέ ίζημα με το αντιδραστήριο Nessler, δηλαδή ένα αλκαλικό διάλυμα K2HgI4.
6. Με διάλυμα θειικού χαλκού:
Με διάλυμα θειικού χαλκού, η αμμωνία δίνει ένα βαθύ μπλε διάλυμα.
Εμφάνιση αμμωνίας πέρα από τη Γη
Έχει ανιχνευθεί ότι υπάρχει αμμωνία σε όλο το Ηλιακό Σύστημα. Σε γιγάντιους πλανήτες όπως ο Δίας και ο Κρόνος, υπάρχει με άλλα αέρια όπως το μεθάνιο, το ήλιο και το υδρογόνο. Παγωμένοι κρύσταλλοι αμμωνίας ανιχνεύονται στην επιφάνεια του Κρόνου.
Αμμωνία υπάρχει και στα δύο φεγγάρια του Άρη. Η αμμωνία σε μικρά σώματα στο ηλιακό σύστημα υπακούει σε έναν γεωλογικά σημαντικό αντιψυκτικό χαρακτήρα. Αυτό οφείλεται στο ότι όταν η αμμωνία αναμιγνύεται με νερό, φτάνει σε σημείο τήξης τόσο χαμηλό όσο -100°C.
Φυσική Εμφάνιση Αμμωνίας
Η αμμωνία υπάρχει στη φύση σε ίχνη. Προέρχεται από αζωτούχα ζωικά απόβλητα και φυτική ύλη. Τα νεφρά εκκρίνουν αμμωνία για να εξουδετερώσουν την υπερβολική παραγωγή οξέος. Η αμμωνία και τα άλατά της υπάρχουν επίσης στο νερό της βροχής σε μικρές συγκεντρώσεις. Οι κρύσταλλοι όξινου ανθρακικού αμμωνίου υπάρχουν στο γκουανό της Παταγονίας. Το χλωριούχο αμμώνιο (sal ammononiac) και το θειικό αμμώνιο, δηλαδή το άλας αμμωνίας, είναι άφθονα σε ηφαιστειακές περιοχές. Τα άλατα αμμωνίου εξαπλώνονται σε γόνιμο έδαφος και θαλασσινό νερό.
Συμπέρασμα
Η αμμωνία υπάρχει φυσικά στα επιφανειακά ύδατα, τα υπόγεια ύδατα και τα οικιακά λύματα. Συναρμολογείται σε μεγάλο βαθμό από την οξείδωση-αναγωγή οργανικών ενώσεων που περιέχουν άζωτο και την υδρόλυση της ουρίας. Σε υδάτινα σώματα, υπάρχει φυσικά με τη μείωση των νιτρικών αλάτων σε αναερόβιες συνθήκες.
Είναι μια σημαντική πηγή αζώτου για όλα τα έμβια όντα. Λειτουργεί τόσο ως μεταβολική είσοδος όσο και ως μεταβολικό απόβλητο στη βιόσφαιρα. Στην ατμόσφαιρα της Γης, η αμμωνία ανιχνεύεται επίσης στην ατμόσφαιρα γιγάντιων πλανητών στο διάστημα.
Συχνές ερωτήσεις
1. Είναι επιβλαβής για την υγεία η έκθεση στην αμμωνία;
Α. Η αμμωνία είναι μια διαβρωτική ένωση. Η σοβαρότητα των επιπτώσεων στην υγεία εξαρτάται από τη δόση, την οδό έκθεσης και τη διάρκεια.
- Η έκθεση στα υψηλά επίπεδα αμμωνίας στον αέρα προκαλεί άμεσο κάψιμο των ματιών, της μύτης, του λαιμού και της αναπνευστικής οδού. Μπορεί να προκαλέσει βλάβη στους πνεύμονες, τύφλωση ή θάνατο.
- Η αναπνοή χαμηλότερων συγκεντρώσεων αμμωνίας μπορεί να προκαλέσει ερεθισμό στο λαιμό και τη μύτη και βήχα.
- Η κατανάλωση κανονικών επιπέδων αμμωνίας μπορεί να προκαλέσει εγκαύματα στο λαιμό, το στόμα και το στομάχι. Η επαφή με τα μάτια ή το δέρμα με συμπυκνωμένη αμμωνία μπορεί επίσης να προκαλέσει εγκαύματα και ερεθισμό.
2. Ποιες είναι οι συνέπειες της εισπνοής αμμωνίας;
Α. Όταν εισπνέετε υψηλές ποσότητες αμμωνίας, τα πιο κοινά συμπτώματα περιλαμβάνουν οξεία φλεγμονή της μύτης, του λαιμού και της αναπνευστικής οδού. Μπορεί δυνητικά να οδηγήσει σε αναπνευστική δυσχέρεια ή αναπνευστική ανεπάρκεια. Εάν η συγκέντρωση αμμωνίας στην ατμόσφαιρα είναι χαμηλή, ο ερεθισμός του λαιμού και της μύτης είναι συχνές ανεπιθύμητες ενέργειες.
3. Ποια είναι τα φυσιολογικά επίπεδα αμμωνίας στα δείγματα αίματος;
Α. Τα φυσιολογικά επίπεδα αμμωνίας στα δείγματα αίματος είναι 15 έως 45 µ/dL (11 έως 32 µmol/L). Τα κανονικά επίπεδα αμμωνίας είναι:
- Παιδιά μεγαλύτερα των δύο ετών (ενζυματική):19 έως 60 mcg/dL
- Νήπια και βρέφη, από 10 ημερών έως 2 ετών (ενζυματική):68 έως 136 mcg/dL
- Ηλικία 0 έως 10 ημερών (ενζυματική):170 έως 341 mcg/dL
- Ενήλικες:10 έως 80 mcg/dL
Εάν τα αποτελέσματα των εξετάσεων δείχνουν υψηλότερα από τα κανονικά επίπεδα αμμωνίας, μπορεί να πάσχετε από σύνδρομο Reye ή ηπατική νόσο.
4. Ποια βήματα πρέπει να ακολουθήσετε εάν ένα μεγάλο μέρος του σώματος εκτεθεί σε αμμωνία;
A. Εάν χυθεί αμμωνία σε μεγάλο μέρος του σώματός σας, ακολουθήστε τα παρακάτω βήματα.
- Βγάλτε τα ρούχα όσο το δυνατόν γρηγορότερα και κλείστε τα σε μια πλαστική σακούλα σφιχτά.
- Αποθηκεύστε τη σακούλα με ρούχα λερωμένα με αμμωνία μακριά από άλλους.
- Εάν δεν μπορείτε να αφαιρέσετε γρήγορα τα ρούχα, κόψτε τα.
- Εάν χυθεί αμμωνία στο δέρμα σας, πλύνετε το με μεγάλη ποσότητα νερού και σαπουνιού.
- Εάν απαιτείται, ζητήστε γρήγορα ιατρική συμβουλή.




