Νιτρικό Μαγνήσιο – Δομή, Τύπος, Ιδιότητες, Αντιδράσεις
Το νιτρικό μαγνήσιο ή δινιτρικό μαγνήσιο είναι ένα ανόργανο νιτρικό άλας μαγνησίου. Το νιτρικό μαγνήσιο είναι ένα λευκό κρυσταλλικό στερεό που χρησιμοποιείται συνήθως στην πυροτεχνία, το οποίο είναι υγροσκοπικό στη φύση. Εμφανίζεται φυσικά σε ορυχεία και σπήλαια. Οι ακόλουθες ενότητες διερευνούν τον τύπο για το νιτρικό μαγνήσιο, τη μοριακή του μάζα, τη δομή, τις ιδιότητες και τις χρήσεις του.
Η φόρμουλα για το νιτρικό μαγνήσιο
Ο τύπος για το νιτρικό μαγνήσιο είναι Mg(NO3 )2 . Ο τύπος προέρχεται με τη μέθοδο σταυρωτής. Το σθένος του μαγνησίου είναι συν ένα, ενώ του νιτρικού είναι μείον δύο. Έτσι, ο τύπος γράφεται ως εξής:
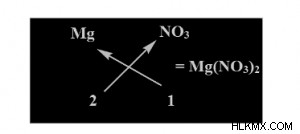
Νιτρικό Μαγνήσιο
Λόγω αυτού του χημικού τύπου, το νιτρικό μαγνήσιο έχει τα ακόλουθα ονόματα:
- Δινιτρικό μαγνήσιο (όνομα IUPAC)
- Magniosan
- Νιτρομαγνησίτης
- Εξαένυδρο νιτρικό μαγνήσιο
Όταν το νιτρικό μαγνήσιο εκτίθεται στον αέρα, μετατρέπεται στην εξαένυδρη μορφή του (Mg(NO3 )2 .6Η2 Ο) καθώς είναι ιδιαίτερα υγροσκοπικό. Ωστόσο, το νιτρικό μαγνήσιο ονομάζεται νιτρομαγνησίτης όταν εμφανίζεται φυσικά σε εξαϋδρική μορφή.
Δομή νιτρικού μαγνησίου
Το νιτρικό μαγνήσιο περιλαμβάνει ιόντα μαγνησίου και νιτρικών. Η δομή του μαγνησίου είναι η εξής:
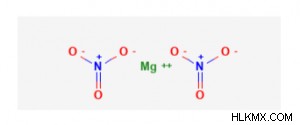
Νιτρικό Μαγνήσιο
Περιέχει ένα κατιόν μαγνησίου και δύο νιτρικά ανιόντα. Ένας ιοντικός δεσμός εμφανίζεται μεταξύ ιόντων μαγνησίου και νιτρικών. Επομένως, η ένωση είναι μια ιοντική ένωση. Ομοιοπολικοί δεσμοί υπάρχουν στην ένωση νιτρικών ανιόντων καθώς κάθε άζωτο συνδέεται ομοιοπολικά με τρία άτομα οξυγόνου.
Lewis Dot Structure of Nitrate Magnesium
Για να σχεδιάσετε τη δομή Lewis του Mg(NO3 )2 , πρέπει να κατανοήσετε τις ακόλουθες έννοιες:
Οι ιοντικές ενώσεις σχηματίζονται όταν τα μέταλλα αντιδρούν με τα αμέταλλα και δημιουργούν ένα τακτοποιημένο κρυσταλλικό στερεό. Το νιτρικό μαγνήσιο είναι μια ιοντική ένωση και συγκρατείται με ιοντικούς δεσμούς. Η ένωση έχει ένα συνολικό ουδέτερο φορτίο παρόλο που περιέχει θετικά και αρνητικά φορτισμένα ιόντα.
Το νιτρικό ανιόν στην ένωση περιέχει ομοιοπολικό δεσμό. Μπορούμε να γράψουμε την ομοιοπολική δομή Lewis ως εξής:
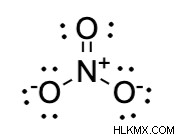
Νιτρικό ιόν
Ωστόσο, όταν πρέπει να γράψετε την τελική δομή Lewis του νιτρικού μαγνησίου, πρέπει να ακολουθήσετε τον κανόνα των ιοντικών ενώσεων ως εξής:
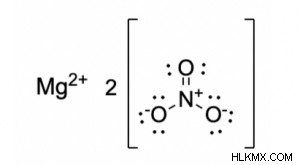
Lewis Structure of Nitrate Magnesium
Παρασκευή νιτρικού μαγνησίου
Διάφορες μέθοδοι έχουν χρησιμοποιηθεί για την παρασκευή νιτρικού μαγνησίου σε εργαστήρια. Μερικές από τις πιο δημοφιλείς μεθόδους προετοιμασίας κοινοποιούνται παρακάτω:
Από υδροξείδιο του μαγνησίου και νιτρικό οξύ
Όταν ένα mole υδροξειδίου του μαγνησίου αντιδρά με δύο mole νιτρικού οξέος, δίνει ένα mole νιτρικού μαγνησίου. Το νιτρικό οξύ λειτουργεί ως παράγοντας αφυδάτωσης στην αντίδραση. Η ισορροπημένη χημική αντίδραση είναι η εξής:
Mg(OH)2 +2 HNO3 →Mg(ΟΧΙ3 )2 +2 H2 O
Από θειικό μαγνήσιο και νιτρικό ασβέστιο
Το νιτρικό μαγνήσιο μπορεί να ληφθεί όταν το θειικό μαγνήσιο αντιδρά με το νιτρικό ασβέστιο. Η ισορροπημένη χημική εξίσωση για την αντίδραση είναι η εξής:
MgSO4 + Ca(NO3 )2 → Mg(ΟΧΙ3 )2 + CaSO4
Από οξείδιο του μαγνησίου και νιτρικό οξύ
Όπως και η προηγούμενη μέθοδος παρασκευής, όταν το νιτρικό οξύ αντιδρά με το οξείδιο του μαγνησίου, δίνει νιτρικό μαγνήσιο και νερό. Η χημική αντίδραση μπορεί να αναπαρασταθεί ως εξής:
MgO+ 2 HNO3 →Mg(ΟΧΙ3 )2 +H2 O
Από ανθρακικό μαγνήσιο και νιτρικό οξύ
Ένα άλλο άλας μαγνησίου, το ανθρακικό μαγνήσιο, μπορεί να αντιδράσει με το νιτρικό οξύ για να παράγει νιτρικό μαγνήσιο. Η χημική εξίσωση για την αντίδραση μπορεί να αναπαρασταθεί ως εξής:
MgCO3 + 2 HNO3 →CO2 + Mg(NO3 )2 +H2 O
Από μαγνήσιο και αραιό νιτρικό οξύ
Μπορείτε επίσης να χρησιμοποιήσετε μαγνήσιο αντί για άλατά του για την παραγωγή νιτρικού μαγνησίου. Η χημική εξίσωση μπορεί να αναπαρασταθεί ως εξής:
Mg(s) + 2 HNO3 (aq) → Mg(NO3 )2 (aq) + H2 (ζ)
Ιδιότητες του νιτρικού μαγνησίου
- Μοριακή μάζα νιτρικού μαγνησίου:148,32 g/mol (άνυδρο)
- Πυκνότητα:2,3 g/cm3 (άνυδρο)
- Χρώμα:Λευκό
- Κατάσταση:Κρυσταλλικό στερεό
- Σημείο τήξεως:129 °C
- Σημείο βρασμού:330 °C
- Διαλυτότητα:Ευδιάλυτο στο νερό και μέτρια σε αμμωνία και αιθανόλη
- Φύση:Υγροσκοπικό
- Κρυσταλλική δομή:Κυβική
Υπολογισμός μοριακής μάζας νιτρικού μαγνησίου
Μπορείτε εύκολα να υπολογίσετε τη μοριακή μάζα νιτρικού μαγνησίου χρησιμοποιώντας τον χημικό τύπο Mg(NO3 )2.
Το ατομικό βάρος ενός ατόμου Mg είναι 24.
Άζωτο =14
Οξυγόνο =16
Η μοριακή μάζα του νιτρικού μαγνησίου =Ατομικό βάρος 1 ατόμου Mg + Ατομικό βάρος 2 ατόμων αζώτου + Ατομικό βάρος 6 ατόμων οξυγόνου
Μοριακή μάζα νιτρικού μαγνησίου =1×24 + 2×14 + 6×16
Συνολική μάζα =24 + 28 +96
Ολική μάζα =148 g/mol
Επομένως, η μοριακή μάζα του νιτρικού μαγνησίου είναι 148 g/mol.
Χημικές αντιδράσεις νιτρικού μαγνησίου
Το μαγνήσιο αντιδρά με διάφορα υδροξείδια και ανθρακικά για να δώσει τα επιθυμητά προϊόντα. Ακολουθούν μερικές από τις σημαντικές αντιδράσεις του νιτρικού μαγνησίου:
Αντίδραση με υδροξείδια
Το νιτρικό μαγνήσιο αντιδρά με υδροξείδιο νατρίου ή άλλο υδροξείδιο αλκαλιμετάλλου για να δώσει την ακόλουθη αντίδραση:
Mg(NO3 )2 + 2 NaOH → Mg(OH)2 + 2 NaNO3
Αντίδραση αποσύνθεσης
Το νιτρικό μαγνήσιο έχει ισχυρή συγγένεια με το νερό. Κατά τη θέρμανση, αποσυντίθεται σε οξυγόνο, οξείδιο μαγνησίου και οξείδιο του αζώτου.
2 Mg(ΟΧΙ3 )2 → 2 MgO + 4 ΟΧΙ2 + O2
Αντίδραση διπλής αποσύνθεσης με ανθρακικό νάτριο
Αντιδρά με ανθρακικό νάτριο και παράγει ανθρακικό μαγνήσιο και νιτρικό νάτριο.
Mg(NO3 )2 + Na2 CO3 → MgCO3 + 2 NaNO3
Αντίδραση με νερό
Αποσυντίθεται στο νερό για να δώσει υδροξείδιο του μαγνησίου, οξυγόνο και αμμωνία. Η ακόλουθη εξίσωση αντιπροσωπεύει την αντίδραση:
Mg(NO3 )2 + 4 H2 O → Mg(OH)2 + 2 NH3 + 4 O2
Θερμική αποσύνθεση κατά τη θέρμανση
Όταν το νιτρικό μαγνήσιο θερμαίνεται, αποσυντίθεται για να δώσει οξείδιο του μαγνησίου. Η αντίδραση προχωρά ως εξής:
2 Mg(ΟΧΙ3 )2 → 2 MgO + 4 ΟΧΙ2 + O2
Αντίδραση με θειικό οξύ
Το νιτρικό μαγνήσιο και το θειικό οξύ αντιδρούν για να σχηματίσουν νιτρικό οξύ και θειικό μαγνήσιο. Η χημική εξίσωση μπορεί να αναπαρασταθεί ως εξής:
H2 SO4 +Mg(NO3 )2 → MgSO4 +2 HNO3
Χρήσεις νιτρικού μαγνησίου
Το νιτρικό μαγνήσιο βρίσκει χρήση σε διάφορες βιομηχανίες, συμπεριλαμβανομένου του
- Χρησιμοποιείται ως απευαισθητοποιητικό για λιθογραφικές πλάκες.
- Χρησιμοποιείται ως αφυδατικός παράγοντας στην παρασκευή συμπυκνωμένου νιτρικού οξέος και στον καθαρισμό του.
- Στην κατασκευή πετροχημικών προϊόντων
- Στην παραγωγή νιτρικού αμμωνίου.
- Ως ρυθμιστής ιξώδους σε διάφορες βιομηχανίες
- Στην κατασκευή γεωργικών προϊόντων
- Στη διαδικασία εξόρυξης
- Χρησιμοποιείται για την κατασκευή προϊόντων τόνερ και χρωστικών.
- Το νιτρικό μαγνήσιο μπορεί επίσης να χρησιμοποιηθεί ως συνδετικός παράγοντας.
Οφέλη από τη χρήση λιπασμάτων νιτρικού μαγνησίου
Τα λιπάσματα νιτρικού μαγνησίου παρέχουν στα φυτά άμεσα διαθέσιμα μακροθρεπτικά συστατικά-μαγνήσιο. Τα κύρια οφέλη από τη χρήση νιτρικού μαγνησίου είναι τα ακόλουθα:
- Είναι απαραίτητο για την υγιή ανάπτυξη των φυτών.
- Επίσης, διευκολύνει την πρόσληψη μαγνησίου από το φυτό.
- Η έλλειψη κατάλληλου μαγνησίου οδηγεί σε νέκρωση στα φυτά.
- Εμπλουτίζει τη διατροφή των φυτών και τους παρέχει ζωντάνια.
- Δεδομένου ότι το μαγνήσιο είναι το κεντρικό άτομο σε ένα μόριο χλωροφύλλης, η ανεπάρκειά του προκαλεί έλλειψη χλωροφύλλης και ως εκ τούτου καθυστερεί την ανάπτυξη των φυτών. Αντίθετα, η επαρκής προσφορά μαγνησίου αυξάνει την ανάπτυξη.
Κίνδυνοι για την υγεία από το νιτρικό μαγνήσιο
Η σοβαρότητα της επίδρασης του νιτρικού μαγνησίου εξαρτάται από το επίπεδο έκθεσης. Λιγότερη έκθεση στο νιτρικό μαγνήσιο μπορεί να οδηγήσει στις ακόλουθες καταστάσεις:
- Ήπιος ερεθισμός στους βλεννογόνους
- Δύσπνοια
- Βήχας
Η έκθεση σε μεγάλες ποσότητες νιτρικού μαγνησίου μπορεί να οδηγήσει σε:
- Ζάλη
- Έμετος
- Αδυναμία
- Σύμπτυξη
- Πόνος στην κοιλιά
- Αιματηρή διάρροια
- Σσπασμοί
Όταν το νιτρικό μαγνήσιο έρχεται σε επαφή με το δέρμα, προκαλεί:
- Ερυθρότητα
- Ερεθισμός
- Πόνος
Εκτός από τον αντίκτυπό της στους ανθρώπους, η ένωση μπορεί να είναι επικίνδυνη εάν χειριστείτε απρόσεκτα. Μπορεί να οδηγήσει σε βίαιη καύση όταν έρχεται σε επαφή με οξειδωτικές ενώσεις. Επίσης, πρέπει να είστε προσεκτικοί όταν θερμαίνετε αυτήν την ένωση καθώς αποσυντίθεται για να εκπέμπει τοξικούς ατμούς οξειδίων του αζώτου.
Συμπέρασμα
Τώρα γνωρίζουμε ότι το νιτρικό μαγνήσιο είναι μια ανόργανη χημική ένωση με τον χημικό τύπο Mg(NO3 )2 . Είναι υγροσκοπικής φύσης και εμφανίζεται συνήθως ως λευκό κρυσταλλικό στερεό σε θερμοκρασία δωματίου. Το νιτρικό μαγνήσιο είναι μια ιοντική ένωση. Μπορείτε εύκολα να αποκτήσετε νιτρικό μαγνήσιο αντιδρώντας νιτρικό οξύ με άλατα μαγνησίου. Βρίσκει την εφαρμογή του στην κλωστοϋφαντουργία, την εξόρυξη, τη γεωργία και πολλές άλλες βιομηχανίες. Ωστόσο, πρέπει να είστε προσεκτικοί όταν χειρίζεστε το νιτρικό μαγνήσιο καθώς χρησιμεύει ως ερεθιστικό.
Συχνές ερωτήσεις
1. Ποια είναι η χρήση του νιτρικού μαγνησίου στην παραγωγή νιτρικού οξέος;
Α. Το νιτρικό μαγνήσιο χρησιμοποιείται στην παρασκευή συμπυκνωμένου νιτρικού οξέος καθώς εξάγει νερό και παρέχει συμπυκνωμένους ατμούς οξέος έως και 90–95 τοις εκατό.
2. Είναι το νιτρικό μαγνήσιο όξινο;
Α. Το νιτρικό μαγνήσιο είναι ένα κρυσταλλικό στερεό, αλλά είναι εξαιρετικά υγροσκοπικό. Έχει pH περίπου 5-7 και επομένως είναι όξινης φύσης.
3. Ποιο μέταλλο θα αντιδράσει με το νιτρικό μαγνήσιο;
Α. Το νιτρικό μαγνήσιο δεν αντιδρά με ψευδάργυρο, μόλυβδο και χαλκό επειδή το μαγνήσιο είναι υψηλότερο από αυτά στη σειρά αντιδραστικότητας, δηλαδή είναι πιο δραστικό από άλλα μέταλλα. Έτσι, αυτά τα μέταλλα δεν μπορούν να εκτοπίσουν ιόντα μαγνησίου από το διάλυμα.
4. Είναι υγιές το νιτρικό μαγνήσιο;
A. Όχι, το νιτρικό μαγνήσιο είναι επιβλαβές σε περίπτωση κατάποσης ή εισπνοής. Μπορεί να προκαλέσει ερεθισμό του δέρματος καθώς και αλλεργικές αντιδράσεις στα μάτια και την αναπνευστική οδό. Ερεθίζει ή καίει την αναπνευστική οδό ανάλογα με το επίπεδο έκθεσης. Το άτομο βιώνει βήχα και δύσπνοια.
5. Πώς μπορείτε να αποκτήσετε κρυστάλλους νιτρικού μαγνησίου;
Α. Αν και το νιτρικό μαγνήσιο είναι υγροσκοπικό, μπορείτε να αποκτήσετε τους κρυστάλλους του στεγνώνοντάς το. Θα πρέπει να το ζεστάνετε απαλά σε υδατόλουτρο. Ψύξτε το συμπυκνωμένο διάλυμα για να λάβετε κρυστάλλους. Η διαδικασία θέρμανσης πρέπει να είναι αργή. Διαφορετικά, το νιτρικό μαγνήσιο θα αποσυντεθεί και θα δώσει οξείδιο του μαγνησίου, οξείδια του αζώτου και οξυγόνο.




