Διαμοριακές δυνάμεις
Τι είναι οι διαμοριακές δυνάμεις;
Οι διαμοριακές δυνάμεις είναι ηλεκτροστατικές αλληλεπιδράσεις μεταξύ μόνιμα ή παροδικά (προσωρινά) φορτισμένων χημικών ειδών. Περιλαμβάνουν δυνάμεις Van Der Waals (αλληλεπιδράσεις), δυνάμεις ιόντος-διπόλου και διπόλου-διπόλου.
Ο όρος χρησιμοποιείται συνήθως για να αναφέρεται μόνο σε ελκυστικές αλληλεπιδράσεις, οι οποίες συγκρατούν μόρια και ιόντα μαζί σε συμπυκνωμένες φάσεις (υγρή και στερεή). Αυτές οι δυνάμεις διέπουν πολλές από τις μεγάλες φυσικές ιδιότητες των ουσιών και των μειγμάτων, όπως το σημείο τήξης, το σημείο βρασμού και η επιφανειακή τάση.
Σχετικά θέματα
- Κατιόντα και ανιόντα
- Ιωνικοί εναντίον ομοιοπολικών δεσμών
- Τι είναι η διπολική στιγμή;
- Συλλογικές ιδιότητες
- Ομογενή έναντι ετερογενών μιγμάτων
Βασικά στοιχεία ιοντικού δεσμού
Οι δυνάμεις ιόντων, γνωστές και ως ιοντικοί δεσμοί, είναι οι πιο απλές στην κατανόηση. Αυτές οι δυνάμεις προκύπτουν από την ηλεκτροστατική έλξη μεταξύ δύο ιόντων με αντίθετα φορτία. τεχνικά δεν θεωρούνται διαμοριακές δυνάμεις , αλλά αποτελούν ένα χρήσιμο σημείο εκκίνησης για την κατανόηση των πραγματικών ΔΝΤ (διαμοριακές δυνάμεις). Οι ιονικοί δεσμοί είναι επίσης γενικά ισχυρότεροι από τις δυνάμεις που συζητούνται παρακάτω, γι' αυτό και τα περισσότερα καθαρά άλατα είναι στερεά εκτός από εξαιρετικά υψηλές θερμοκρασίες.
Ένα τέλειο παράδειγμα αυτού είναι το επιτραπέζιο αλάτι, το NaCl, το οποίο έχει σημείο τήξης 800 βαθμούς Κελσίου.
Τύποι διαμοριακών δυνάμεων
Δυνάμεις Van Der Waals
Δυνάμεις Van der Waals, γνωστό και ως αλληλεπιδράσεις Van der Waals, είναι η πιο αδύναμη διαμοριακή δύναμη και αποτελούνται από ασθενείς δυνάμεις διπόλου-διπόλου και ισχυρότερες δυνάμεις διασποράς του Λονδίνου. Είναι ονόματα του Ολλανδού χημικού Johannes van der Waals (1837-1923). Η εξίσωση Van Der Waals, για τα μη ιδανικά αέρια, λαμβάνει υπόψη αυτές τις διαμοριακές δυνάμεις. Αυτές οι δυνάμεις καθορίζουν εάν μια ουσία είναι στερεή, υγρή ή αέρια σε μια δεδομένη θερμοκρασία.
Υπάρχουν δύο τύποι δυνάμεων Van der Waals που θα συζητήσουμε παρακάτω – δυνάμεις διασποράς του Λονδίνου και δυνάμεις διπόλου-διπόλου (αλληλεπιδράσεις).
Δυνάμεις ιόντων-διπόλων
Οι δυνάμεις ιόντος-διπόλου προκύπτουν από την αλληλεπίδραση ενός φορτισμένου είδους με ένα πολικό μόριο. Μοιάζουν πολύ με τους ιοντικούς δεσμούς, αλλά τείνουν να είναι πιο αδύναμοι επειδή τα πολικά μόρια διαθέτουν μόνο μερικούς ηλεκτρικό φορτίο, το οποίο δημιουργεί λιγότερη ηλεκτροστατική έλξη. Λόγω αυτών των δυνάμεων, οι πολικοί διαλύτες είναι σε καλύτερη θέση να διαλύουν ιοντικά στερεά όπως το NaCl, σε σύγκριση με τους μη πολικούς διαλύτες.
Διπολικές αλληλεπιδράσεις που προκαλούνται από ιόντα
Στενά σχετιζόμενες με τις δυνάμεις ιόντων-διπόλων είναι οι δυνάμεις διπόλων που προκαλούνται από ιόντα. Σε αυτή την περίπτωση, δεν υπάρχει μόνιμο δίπολο στο μόριο. Αντίθετα, το ιόν δημιουργεί ένα παροδικό δίπολο από ένα μη πολικό μόριο έλκοντας ή απωθώντας τα ηλεκτρόνια του. Στη συνέχεια σχηματίζεται μια έλξη μεταξύ του ιόντος και του παροδικού μερικού φορτίου.
Δυνάμεις διπόλου-διπόλου
Η δύναμη δίπολου-διπόλου είναι ένας τύπος δύναμης Van Der Waals . Όταν δύο πολικά μόρια αλληλεπιδρούν, τα αντίθετα μερικά φορτία έλκονται, παρόμοια με τους ιοντικούς δεσμούς, αλλά γενικά πιο αδύναμα, λόγω του μικρότερου μεγέθους φορτίου. Λόγω αυτών των δυνάμεων διπόλου-διπόλου, οι πολικές ενώσεις τείνουν να έχουν υψηλότερα σημεία τήξης και βρασμού από τις μη πολικές ενώσεις.
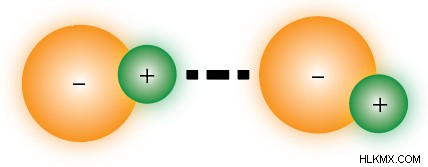
Δεσμός υδρογόνου
Ο δεσμός υδρογόνου είναι ένας ειδικός τύπος αλληλεπίδρασης διπόλου-διπόλου. Μπορεί να συμβεί μόνο όταν τα εν λόγω μόρια έχουν ένα εξαιρετικά ηλεκτραρνητικό άτομο άμεσα συνδεδεμένο με ένα άτομο υδρογόνου, οδηγώντας σε ένα ασυνήθιστα ακραίο δίπολο. Για τους περισσότερους σκοπούς, αυτά τα εξαιρετικά ηλεκτραρνητικά άτομα περιορίζονται μόνο σε άζωτο, οξυγόνο και φθόριο.
Ο δεσμός υδρογόνου περιλαμβάνει ένα μόριο «δότη» και ένα μόριο «δέκτη». Ο δότης παρέχει το άτομο υδρογόνου για τον δεσμό, ενώ ο δέκτης το ηλεκτραρνητικό άτομο. Στην παρακάτω εικόνα, τα δύο κορυφαία μόρια νερού ενεργούν και τα δύο ως δότες, ενώ το κάτω μόριο ενεργεί ως δέκτης. Ορισμένα μόρια μπορούν να λειτουργήσουν μόνο ως αποδέκτες.
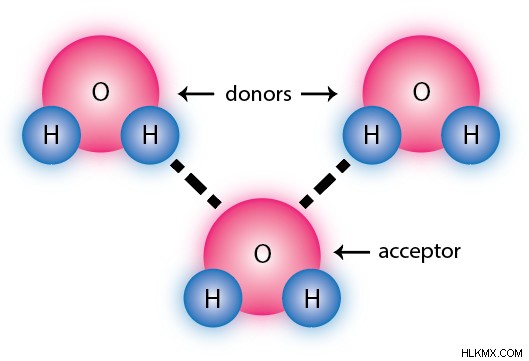
Ο δεσμός υδρογόνου είναι επίσης κατευθυντικός - ένας δεσμός μπορεί να χαρακτηριστεί ως δεσμός υδρογόνου μόνο εάν τα τρία συμμετέχοντα άτομα βρίσκονται σε περίπου ευθεία γραμμή (γωνία 180 μοιρών). Αυτό το ξεχωρίζει περισσότερο από τη συνηθισμένη σύνδεση διπόλου-διπόλου, η οποία δεν έχει κατευθυντικότητα.
Δυνάμεις διασποράς Λονδίνου (LDF)
Οι δυνάμεις διασποράς του Λονδίνου, που συχνά συντομεύονται σε LDF, είναι ελκτικές δυνάμεις μεταξύ δύο μεταβατικών διπόλων . Είναι επίσης ένας τύπος δύναμης Van Der Waals . Αυτό μπορεί να φαίνεται μη διαισθητικό, αλλά όταν δύο μη πολικά μόρια βρίσκονται το ένα κοντά στο άλλο, οι ταλαντώσεις στα νέφη ηλεκτρονίων τους μπορεί να αναγκάσουν και τα δύο να αποκτήσουν κάποια πολικότητα. Αναφερόμαστε στην προκύπτουσα έλξη μεταξύ παροδικών φορτίων ως δυνάμεις διασποράς του Λονδίνου.
Σε ατομική βάση, οι LDF είναι γενικά οι πιο αδύναμες από τις διαμοριακές δυνάμεις. Το σωρευτικό αποτέλεσμα πολλών αλληλεπιδράσεων LDF, ωστόσο, μπορεί να οδηγήσει σε αρκετά υψηλή συνολική έλξη. Ο αριθμός των αλληλεπιδράσεων σχετίζεται στενά με την επιφάνεια επαφής των μορίων, έτσι ένα μεγάλο μη πολικό μόριο μπορεί να έχει αρκετά μεγάλη έλξη από το LDF, ενώ ένα μικρό, συμπαγές μπορεί να έχει πολύ λίγη έλξη. Όταν συγκρίνουμε δύο μόρια παρόμοιου σχήματος (π.χ. δύο ευγενή αέρια), αυτό με τη μεγαλύτερη μοριακή μάζα θα έχει ισχυρότερο LDF.
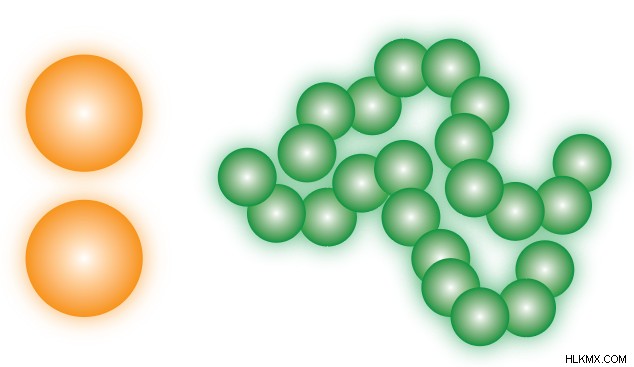
Είναι σημαντικό να σημειωθεί ότι αν και οι δυνάμεις διασποράς του Λονδίνου είναι οι μόνες ΔΝΤ που υπάρχουν σε μη πολικά μόρια, υπάρχουν επίσης σε όλα τα άλλα είδη ουσιών . Τα πολικά μόρια συμμετέχουν επίσης στο LDF, αλλά αυτό μερικές φορές δεν αναφέρεται επειδή είναι λιγότερο σημαντικά από τα άλλα ΔΝΤ σε αυτές τις περιπτώσεις.
Διαμοριακές δυνάμεις:Ισχυρότερες έως Ασθενέστερες
- Ionic (όχι τεχνικά ΔΝΤ)
- Ιόν-δίπολο
- Υδρογόνο
- Δίπολο-δίπολο
- Δύναμη διασποράς του Λονδίνου (δύναμη Van der Waals)
Παραδείγματα:Κατάταξη ισχύος του ΔΝΤ
1. Κατατάξτε τα ακόλουθα μείγματα από τα ισχυρότερα στα πιο αδύναμα ΔΝΤ:
- Αιθανόλη και αμμωνία
- Νερό και χλωριούχο κάλιο
- Οκτάνιο και μεθάνιο
- Χλωροφόρμιο και ακετόνη
2. Κατατάξτε τις ακόλουθες καθαρές ουσίες από το υψηλότερο στο χαμηλότερο σημείο βρασμού:
- Προπάνιο
- Νερό
- Διχλωρομεθάνιο
Διαμοριακές δυνάμεις:Λύσεις:
1. Αναζητήστε τις ισχυρότερες αλληλεπιδράσεις μεταξύ κάθε ζεύγους ενώσεων.
- Νερό και χλωριούχο κάλιο
Αυτά τα δύο είναι ένα πολικό μόριο και μια ιοντική ένωση, επομένως υπάρχουν δυνάμεις ιόντος-διπόλου μεταξύ τους. Αυτές είναι οι ισχυρότερες διαμοριακές δυνάμεις, γενικά. - Αιθανόλη και αμμωνία
Και τα δύο είναι πολικά μόρια, επομένως έχουν δυνάμεις διπόλου-διπόλου, αλλά το πιο σημαντικό είναι και τα δύο ικανά να δεσμεύουν υδρογόνο, που είναι ισχυρότερο από τις συνηθισμένες αλληλεπιδράσεις διπόλου-διπόλου. - Χλωροφόρμιο και ακετόνη
Και τα δύο είναι πολικά μόρια που δεν μπορούν να εμπλακούν σε δεσμούς υδρογόνου. Έχουν αλληλεπιδράσεις διπόλου-διπόλου. - Το οκτάνιο και το μεθάνιο είναι και τα δύο μη πολικά μόρια, επομένως έχουν μόνο δυνάμεις διασποράς του Λονδίνου. Αυτά είναι τα πιο αδύναμα ΔΝΤ.
ΣΗΜΕΙΩΣΗ: να θυμάστε ότι ΟΛΕΣ οι ουσίες έχουν δυνάμεις διασποράς του Λονδίνου εκτός από όσα άλλα ΔΝΤ έχουν!
2. Θυμηθείτε ότι τα σημεία βρασμού σχετίζονται με την ισχύ του ΔΝΤ. Όσο ισχυρότερα είναι τα ΔΝΤ, τόσο υψηλότερο είναι το σημείο βρασμού.
- Το νερό έχει το υψηλό σημείο βρασμού, γιατί συμμετέχει στις δυνάμεις διπόλου-διπόλου και στους δεσμούς υδρογόνου.
- Το διχλωρομεθάνιο είναι το επόμενο υψηλότερο επειδή συμμετέχει σε δυνάμεις διπόλου-διπόλου.
- Το προπάνιο έχει το χαμηλότερο σημείο βρασμού γιατί συμμετέχει μόνο στις δυνάμεις διασποράς του Λονδίνου.




