Πώς να γράψετε καθαρές ιοντικές εξισώσεις
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε πώς να γράφετε καθαρές ιοντικές εξισώσεις . Επιπλέον, θα μάθετε πώς είναι χρήσιμα για την κατανόηση ποια ιόντα στο διάλυμα είναι ενεργά σε μια αντίδραση και ποια ιόντα θεατή.
Θέματα που καλύπτονται σε άλλα άρθρα
- Χημικές εξισώσεις εξισορρόπησης
- Λίστα κοινών πολυατομικών ιόντων
- Τυπική χρέωση
- Κατιόντα και ανιόντα
Λεξιλόγιο
- Πλήρης ιοντική εξίσωση: μια μοριακή εξίσωση που χωρίζει τα μόρια στις μορφές ιόντων τους.
- Καθαρή ιοντική εξίσωση: μια μοριακή εξίσωση που απεικονίζει τα ιόντα ή τα μόρια που παρουσιάζουν μια αλλαγή μέσα σε μια αντίδραση.
- Ιόν θεατή: ιόντων σε μια αντίδραση που δεν υφίστανται καμία αλλαγή.
- Υδατικό διάλυμα: ένα διάλυμα στο οποίο ο διαλύτης είναι νερό.
Τι είναι μια καθαρή ιοντική εξίσωση;
Ο ορισμός μιας καθαρής ιοντικής εξίσωσης είναι μια εξίσωση που απεικονίζει μόνο τα μόρια ή τα ιόντα που συμμετέχουν ενεργά στην αντίδραση ή αυτά που υφίστανται μια αλλαγή. Σε αυτήν την εξίσωση, τα ιόντα θεατή δεν υπάρχουν.
Γιατί χρησιμοποιούμε καθαρές ιοντικές εξισώσεις;
Όπως περιγράφηκε παραπάνω, χρησιμοποιούμε καθαρές ιοντικές εξισώσεις για να τονίσουμε τα μόρια που υφίστανται μια αλλαγή στην αντίδραση. Καθιστά εύκολο να δούμε τα ενεργά μόρια σε μια αντίδραση, αφού είναι τα μόνα που υπάρχουν στην εξίσωση!
Γράψιμο καθαρών ιοντικών εξισώσεων
Το πρώτο βήμα για τη σύνταξη μιας καθαρής ιοντικής εξίσωσης είναι η εξισορρόπηση της παρούσας χημικής εξίσωσης. Ας χρησιμοποιήσουμε την αντίδραση μεταξύ χλωριούχου νατρίου και νιτρικού αργύρου ως παράδειγμα.
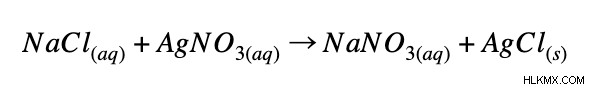
Στη συνέχεια, γράφουμε τη χημική εξίσωση ως πλήρη ιοντική εξίσωση. Αυτό σημαίνει ότι διαχωρίζουμε κάθε μόριο στη μορφή ιόντων. (Σημειώστε ότι μόνο υδατικές ενώσεις μπορεί να διαχωριστεί.) Εάν η ένωση είναι στερεή ή υγρή, πρέπει να παραμείνει στη μοριακή της μορφή. Η πλήρης ιοντική εξίσωση για την παραπάνω αντίδραση θα είναι η εξής:
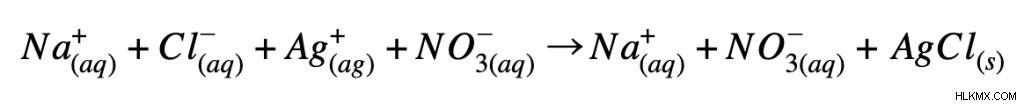
Τέλος, μπορούμε να χρησιμοποιήσουμε την πλήρη ιοντική εξίσωση για να γράψουμε την καθαρή ιοντική εξίσωση. Αρχικά, αναγνωρίζουμε τα ιόντα του θεατή. Εξετάζοντας την πλήρη ιοντική εξίσωση, τα ιόντα θεατή θα έχουν το ίδιο φορτίο και κατάσταση ύλης στα αντιδρώντα και τα προϊόντα. Σε αυτή την αντίδραση, το ιόν νατρίου και το νιτρικό ιόν δεν αλλάζουν. Ως αποτέλεσμα, αυτά θεωρούνται ιόντα θεατών. Για να γράψουμε την καθαρή ιοντική εξίσωση, πρέπει απλώς να αφαιρέσουμε τα ιόντα θεατή.
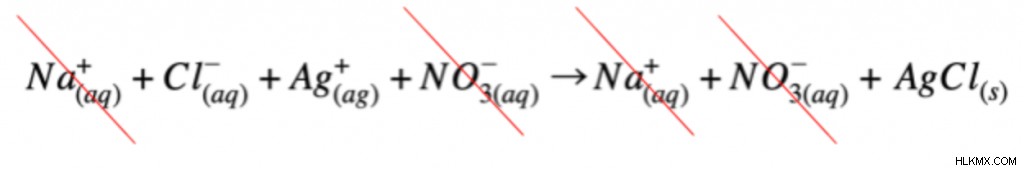
Αφού αφαιρέσουμε τα ιόντα θεατή, μας μένει η καθαρή ιοντική εξίσωση!
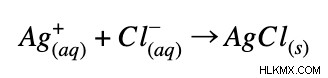
Μπορούμε να επαναλάβουμε αυτή τη διαδικασία για οποιαδήποτε αντίδραση και να λάβουμε την καθαρή ιοντική εξίσωση.
Παραδείγματα καθαρών ιοντικών εξισώσεων
Ακολουθούν μερικά παραδείγματα άλλων χημικών αντιδράσεων και πώς μοιάζει η καθαρή ιοντική τους εξίσωση.
Παράδειγμα 1:
Πλήρης ιοντική εξίσωση:
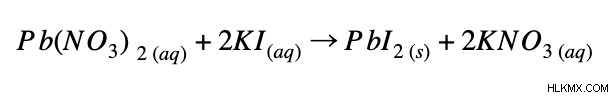
Καθαρή ιοντική εξίσωση:
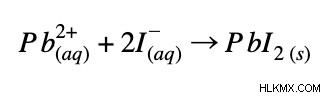
Παράδειγμα 2:
Πλήρης ιοντική εξίσωση:
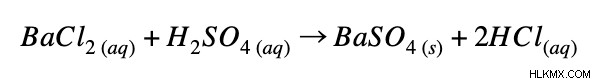
Καθαρή ιοντική εξίσωση:
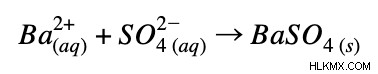
Παράδειγμα 3:
Πλήρης ιοντική εξίσωση:
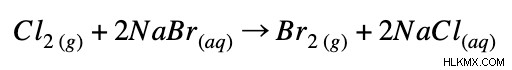
Καθαρή ιοντική εξίσωση:
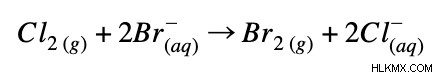
Εξαιρετικό πείραμα στο σπίτι
Για να κατανοήσετε ακόμη καλύτερα μια καθαρή ιοντική εξίσωση, μπορείτε να εκτελέσετε αυτό το διασκεδαστικό, ασφαλές και απλό πείραμα οικιακής χημείας. Και μάλλον έχετε όλα όσα χρειάζεστε! Παρακολουθήστε το βίντεο και εγγραφείτε στο κανάλι μας στο YouTube - πολλά περισσότερα εκπληκτικά βίντεο είναι καθ' οδόν!
Η καθαρή εξίσωση για την αντίδραση στο βίντεο είναι Mg + CO3 -> MgCO3 (s)
Περαιτέρω ανάγνωση
- Αντιδράσεις οξειδοαναγωγής
- Εξισορρόπηση αντιδράσεων οξειδοαναγωγής
- Παραγωγή σκόνης χαλκού από φύλλο αλουμινίου