Η Λειτουργική Ομάδα Κετόνης
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε για τη λειτουργική ομάδα κετόνης , πώς να το ονομάσετε, τις ιδιότητές του και τις αντιδράσεις του. Θα μάθετε επίσης για τις κετόνες σε σύγκριση με άλλες παρόμοιες λειτουργικές ομάδες.
Θέματα που καλύπτονται σε άλλα άρθρα
- Λειτουργική ομάδα καρβονυλίου
- Αντίδραση συμπύκνωσης Aldol
- Ταυτομερισμός κετοενόλης
- Αντίδραση Diels-Alder
Τι είναι η κετόνη;
Κετόνες αποτελούν μια κοινή λειτουργική ομάδα στην οργανική χημεία. Οι κετόνες έχουν σημαντικές φυσιολογικές ιδιότητες. Ως αποτέλεσμα, αποτελούν μέρος πολλών σακχάρων και ενώσεων που εμπλέκονται στην ιατρική χρήση, όπως η κορτιζόνη, ένα αντιφλεγμονώδες.
Μια κοινή κετόνη είναι η ακετόνη (CH3 COCH3 ). Η ακετόνη είναι διαλυτή στο νερό και μπορεί να διαλύσει πολλές οργανικές ενώσεις. Έχει χαμηλό σημείο βρασμού 56℃ που του επιτρέπει να απομακρύνεται από τις αντιδράσεις με εξάτμιση. Εμπλέκεται συνήθως σε βιομηχανικούς διαλύτες, όπως διαβρωτικά χρωμάτων και καθαριστικά βερνικιού νυχιών.
Δομή κετόνης
Οι κετόνες έχουν μια καρβονυλομάδα όπου οάνθρακας είναι ομοιοπολικά διπλός δεσμός με ένα οξυγόνο άτομο. Οι άλλοι δύο δεσμοί είναι είτε με άλλα άτομα άνθρακα είτε με ρίζες υδρογονάνθρακα. Το Rand R υποδηλώνει πανομοιότυπες ή διαφορετικές αλυσίδες άνθρακα.
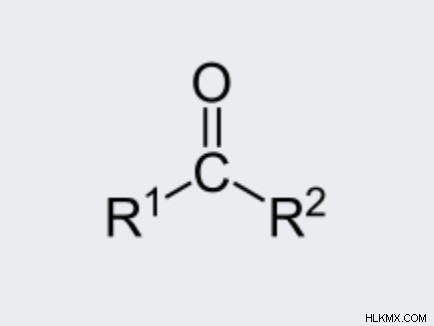
Λόγω της δομής της, ο πιο βασικός μοριακός τύπος μιας κετόνης είναι το RCOR . Αυτό μπορεί να αναφέρεται ως Κέτο ομάδα καθώς η ομάδα -CO- συνδέεται με άτομα άνθρακα και στις δύο πλευρές.
Καρβονύλιο έναντι κετόνης
Είναι σημαντικό να σημειωθεί η διαφορά μεταξύ καρβονυλίου και κετόνης. Η διαφορά είναι ότι οι ομάδες καρβονυλίου έχουν ένα άτομο άνθρακα με ένα άτομο οξυγόνου με διπλούς δεσμούς, ενώ οι κετόνες περιέχουν μια ομάδα καρβονυλίου συνδεδεμένη με ομάδες αλκυλίου. Το κύριο στοιχείο είναι ότι οι καρβονυλικές ομάδες αποτελούν μέρος των κετονών και όχι το αντίστροφο
Ονομασία κετόνων
Όταν ονομάζουμε κετόνες με βάση τους κανόνες IUPAC, η μεγαλύτερη ανθρακική αλυσίδα που περιέχει την ομάδα καρβονυλίου είναι η μητρική. Ως αποτέλεσμα, αυτή η αλυσίδα αριθμείται προς την κατεύθυνση που δίνει στην ομάδα καρβονυλίου τον μικρότερο αριθμό. Το επίθημα του «-e» από το μητρικό αλκάνιο αλλάζει σε «-one». Αρκετά παραδείγματα κετονών φαίνονται παρακάτω.

Αλδεΰδες εναντίον κετόνης
Οι αλδεΰδες και οι κετόνες έχουν παρόμοια χημική σύσταση και μοριακή δομή. Και οι δύο έχουν μια λειτουργική ομάδα καρβονυλίου. Η μόνη διαφορά είναι τα άτομα στον άνθρακα καρβονυλίου.

Οι αλδεΰδες έχουν μια ομάδα R στη μία πλευρά του καρβονυλίου και ένα άτομο υδρογόνου στην άλλη. Η ομάδα R σε μια αλδεΰδη μπορεί να είναι είτε υδρογονανθρακική αλυσίδα είτε Υδρογόνο. Αντίθετα, οι κετόνες έχουν υποκαταστάτες R και R' συνδεδεμένους με τον άνθρακα καρβονυλίου. Εκτός από τη δομή, υπάρχουν πέντε αξιοσημείωτες διαφορές.
- Γενικές φόρμες :Οι αλδεΰδες έχουν τη γενική μορφή R-CHO, ενώ οι κετόνες τη γενική μορφή R-CO-R.
- Χημική αντιδραστικότητα: Οι αλδεΰδες είναι πιο χημικά αντιδραστικές από τις κετόνες. Οι κετόνες δεν μπορούν να οξειδωθούν εύκολα χωρίς να σπάσει η ανθρακική αλυσίδα.
- Θέση καρβονυλίου :Η λειτουργική ομάδα αλδεΰδης βρίσκεται στο τέλος της ανθρακικής αλυσίδας λόγω της προσκόλλησης υδρογόνου. Ωστόσο, η λειτουργική ομάδα κετόνης βρίσκεται πάντα στη μέση της ανθρακικής αλυσίδας.
- Τυπικό περιστατικό :Οι αλδεΰδες βρίσκονται με πτητικές ενώσεις, ενώ οι κετόνες βρίσκονται στα σάκχαρα.
- Ονοματολογία IUPAC :Η ονοματολογία των αλδεΰδων χρησιμοποιεί το επίθημα "-al" ενώ οι κετόνες χρησιμοποιούν το επίθημα "-one".
Αντιδράσεις κετονών
Οι κετόνες είναι σε θέση να υποστούν πολλούς διαφορετικούς τύπους αντιδράσεων. Η παρακάτω λίστα ονομάζει τις πιο συχνές αντιδράσεις στις οποίες μπορεί να υποστούν.
- Πυρηνόφιλες αντιδράσεις προσθήκης
- Αντιδράσεις μείωσης
- Αντιδράσεις οξείδωσης
- Αντιδράσεις συμπύκνωσης Aldol
Πυρηνόφιλη αντίδραση προσθήκης
Οι κετόνες χρησιμοποιούν πυρηνόφιλες αντιδράσεις προσθήκης όπου το πλούσιο σε ηλεκτρόνια πυρηνόφιλο επιτίθεται στα ηλεκτρόφιλα με έλλειψη ηλεκτρονίων. Στις κετόνες, το άτομο άνθρακα εντός του καρβονυλίου δρα ως ηλεκτρόφιλο.
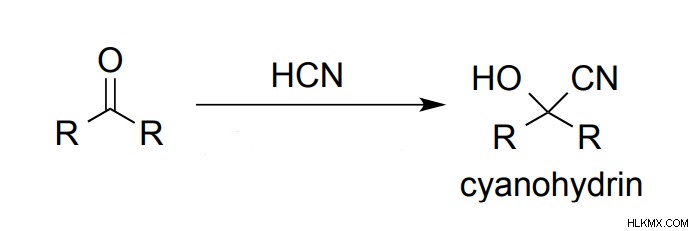
Προσθήκη κυανίου
Οι κετόνες αντιδρούν με το HCN (υδροκυανίδιο) για να παράγουν κυανυδρίνες. Ως αποτέλεσμα, το CN (ισχυρό πυρηνόφιλο) προστίθεται στην καρβονυλική ένωση για να δώσει μια κυανοϋδρίνη.
Προσθήκη αντιδραστηρίων Grignard
Οι κετόνες αντιδρούν επίσης με τα αντιδραστήρια Grignard για να σχηματίσουν αλκοόλες. Το αντιδραστήριο Grignard προστίθεται στην καρβονυλική ομάδα χρησιμοποιώντας πυρηνόφιλη προσθήκη. Ως αποτέλεσμα, αυτό παράγει ένα πρόσθετο που στη συνέχεια δημιουργεί ένα αλκοόλ. Η αντίδραση με κετόνες αποδίδει τριτοταγή αλκοόλη.
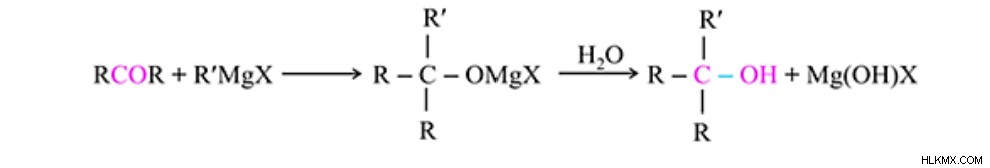
Αντίδραση μείωσης
Οι κετόνες μπορούν να υποστούν αναγωγή όπου υπάρχει απώλεια οξυγόνου και αύξηση υδρογόνου.
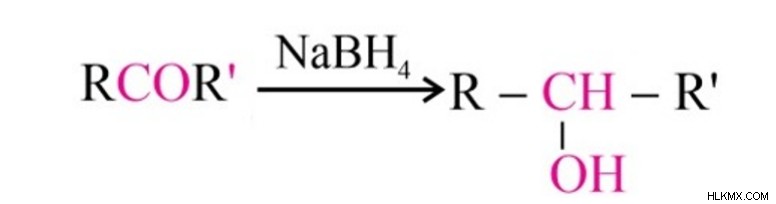
Μείωση στα αλκοόλ
Οι κετόνες μειώνονται στις αντίστοιχες αλκοόλες τους μέσω της καταλυτικής υδρογόνωσης. Η προσθήκη υδρογόνου γίνεται είτε παρουσία καταλυτών (πλατίνα, νικέλιο) είτε σε βοριοϋδρίδιο του νατρίου (NaBH4 ). Σε αυτή τη διαδικασία, οι κετόνες παράγουν δευτεροταγείς αλκοόλες.
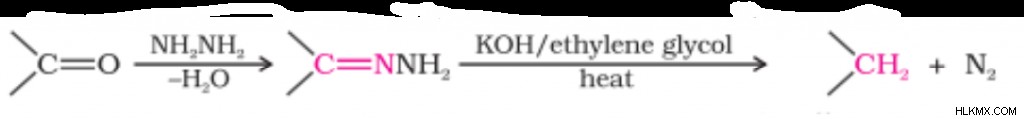
Αντίδραση Wolff-Kishner
Στην αναγωγή Wolff-Kishner, η καρβονυλική ομάδα σε μια κετόνη μειώνεται σε CH2 ομάδα. Για να μάθετε περισσότερες λεπτομέρειες σχετικά με αυτήν την αντίδραση, διαβάστε το άρθρο Αντίδραση μείωσης του Wolff-Kishner.
Αντίδραση οξείδωσης
Οι κετόνες μπορούν να υποστούν αντιδράσεις οξείδωσης αλλά απαιτούν ισχυρούς οξειδωτικούς παράγοντες και υψηλές θερμοκρασίες. Η οξείδωση συνίσταται σε διάσπαση δεσμού άνθρακα-άνθρακα και σχηματισμό καρβοξυλικού οξέος.
Αντίδραση συμπύκνωσης Aldol
Οι κετόνες μπορούν να υποστούν αντιδράσεις συμπύκνωσης Aldol.
Περαιτέρω ανάγνωση
- Προθέματα χημείας
- Νόμος Beer-Lambert
- Νόμος του Χένρι




