Οι περιοδικές τάσεις γίνονται εύκολα!
Τι είναι οι Περιοδικές Τάσεις;
Περιοδικές τάσεις είναι παρατηρήσιμα μοτίβα στις ιδιότητες ενός στοιχείου που εξαρτώνται από τη θέση του στον Περιοδικό Πίνακα. Αυτές οι τάσεις επέτρεψαν στους επιστήμονες στο παρελθόν να προβλέψουν ορισμένα χαρακτηριστικά άγνωστων στοιχείων. Αυτό οφείλεται στις δομικές ομοιότητες που έχουν τα στοιχεία μιας περιόδου ή μιας οικογένειας που επιτρέπει την πραγματοποίηση αυτών των τάσεων. Συζητάμε τάσεις για ιδιότητες όπως η ηλεκτραρνητικότητα, η ατομική ακτίνα, η ενέργεια πρώτου ιονισμού, η αντιδραστικότητα και η συγγένεια ηλεκτρονίων.
Ποιες ιδιότητες μπορούν να αναγνωριστούν χρησιμοποιώντας περιοδικές τάσεις;
Ηλεκτραρνητικότητα:
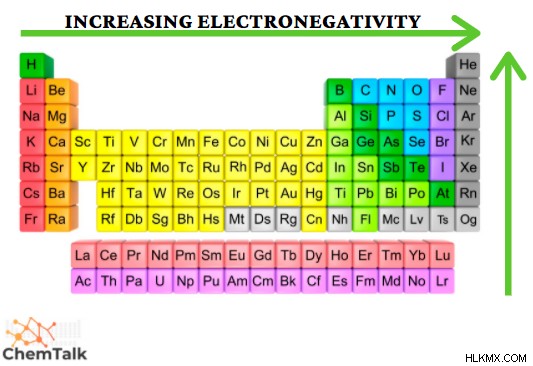
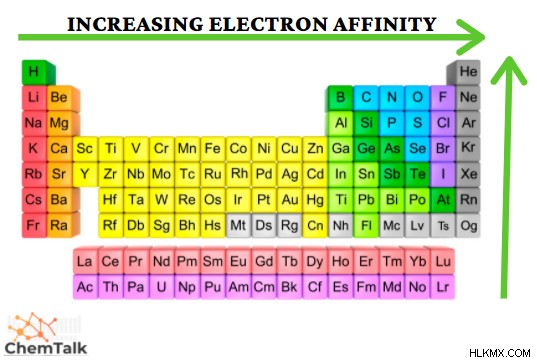
Η ηλεκτροαρνητικότητα είναι μια ιδιότητα που μετρά την τάση ενός ατόμου να προσελκύει ηλεκτρόνια για να σχηματίσει δεσμό. Η κλίμακα που σχηματίστηκε για να μετρηθεί αυτή η ιδιότητα είναι η κλίμακα Pauling. Δημιουργήθηκε με τη μέτρηση της ενέργειας του δεσμού των διαφορετικών στοιχείων που ενώνονται με ομοιοπολικό δεσμό. Αυτή η κλίμακα κυμαίνεται από 0,7 έως 4,0, όπου το καίσιο είναι το λιγότερο ηλεκτραρνητικό στοιχείο και το φθόριο είναι το πιο ηλεκτραρνητικό στοιχείο. Αυτό παρατηρείται μέσω των Περιοδικών Τάσεων, καθώς το περαιτέρω δεξιά μιας περιόδου και υψηλότερα σε μια ομάδα παρατηρείται ότι έχουν αυξημένες τιμές ηλεκτραρνητικότητας. Σημειώστε ότι τα ευγενή αέρια δεν έχουν ηλεκτραρνητικότητα.
Ενέργεια ιονισμού:
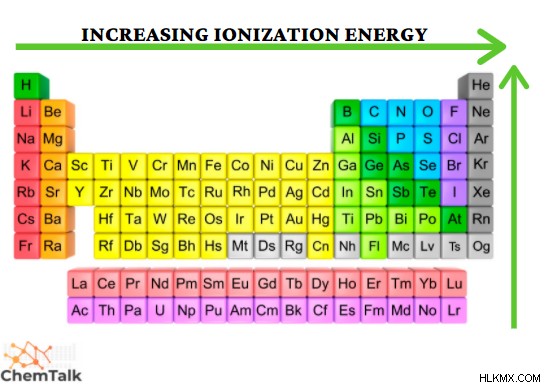
Η ελάχιστη ποσότητα ενέργειας που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου από το εξωτερικό κέλυφος ηλεκτρονίων ενός ουδέτερου ατόμου στην αέρια φάση ονομάζεται ενέργεια ιονισμού .
Αυτή η ιδιότητα περιγράφει τη δυσκολία της αφαίρεσης ενός ηλεκτρονίου. Η ενέργεια ιοντισμού αυξάνεται περαιτέρω ακριβώς κάτω από την περίοδο και υψηλότερα σε μια ομάδα καθώς απαιτείται περισσότερη ενέργεια για να αφαιρεθεί ένα σφιχτά δεσμευμένο ηλεκτρόνιο από το άτομο. Ένα παράδειγμα ενέργειας υψηλού ιονισμού είναι το ήλιο, καθώς έχει πολύ μικρή ατομική ακτίνα με +2 φορτίο που υπάρχει στον πυρήνα. Αυτό επιτρέπει στα ηλεκτρόνια να συγκρατούνται ως αποτέλεσμα αυτών των ελκτικών δυνάμεων.
Αντιδραστικότητα:
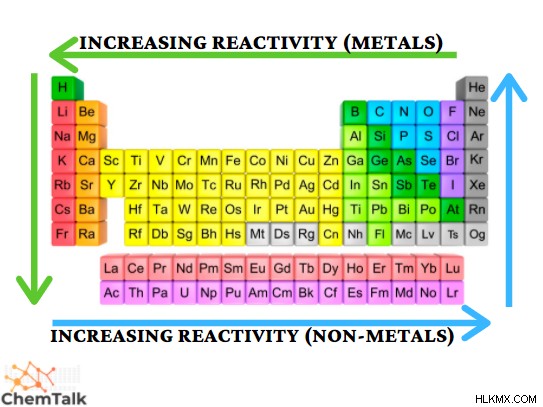
Η αντιδραστικότητα περιγράφει την ικανότητα ενός μορίου ή ατόμου να υποστεί μια χημική αντίδραση, ακολουθούμενη από μια απελευθέρωση ενέργειας. Αυτή η ιδιότητα εξαρτάται από χαρακτηριστικά όπως η ηλεκτραρνητικότητα και η ενέργεια ιοντισμού. Αυτοί είναι παράγοντες που επηρεάζουν τις αλληλεπιδράσεις των ηλεκτρονίων που υφίστανται οι χημικές αντιδράσεις. Η αντιδραστικότητα εξαρτάται από την ταξινόμηση ενός στοιχείου (μέταλλα και μη μέταλλα), καθώς και τα δύο έχουν διαφορετικές περιοδικές τάσεις. Η αντιδραστικότητα των μετάλλων αυξάνεται περαιτέρω αριστερά κατά τη διάρκεια μιας περιόδου και πιο κάτω σε μια ομάδα. Από την άλλη πλευρά, η αντιδραστικότητα στα μη μέταλλα αυξάνεται περαιτέρω δεξιά σε μια περίοδο και πιο πάνω σε μια ομάδα. Το πιο αντιδραστικό στοιχείο που πρέπει να παρατηρηθεί είναι το καίσιο, καθώς αντιδρά αυθόρμητα με τον αέρα και το νερό!
Συγγένεια ηλεκτρονίων:
Η συγγένεια ηλεκτρονίων είναι μια ιδιότητα που περιγράφει την τάση ενός ουδέτερου ατόμου να αποκτά ένα ηλεκτρόνιο, προκειμένου να σχηματίσει ένα αρνητικό ιόν. Σε αυτή τη διαδικασία, απελευθερώνεται ενέργεια, γνωστή και ως εξώθερμη διαδικασία (εξαιρουμένων των ευγενών αερίων). Παρατηρείται μια τάση, καθώς στοιχεία πιο δεξιά από μια περίοδο και ψηλότερα από μια ομάδα έχουν αυξημένη συγγένεια ηλεκτρονίων. Αυτό φαίνεται καθώς τα ηλεκτρόνια που σχηματίζουν τα αρνητικά ιόντα προστίθενται στο εξωτερικό κέλυφος ηλεκτρονίων, προκαλώντας αυξημένη έλξη μεταξύ των ηλεκτρονίων και του πυρήνα. Εξαίρεση σε αυτόν τον κανόνα είναι το στοιχείο με την υψηλότερη συγγένεια ηλεκτρονίων, το χλώριο. Αυτό οφείλεται στο ότι το χλώριο έχει περισσότερο χώρο για ηλεκτρόνια από το φθόριο στο εξώτατο τροχιακό του. Ο μεγαλύτερος χώρος στο τροχιακό του χλωρίου κάνει τα ηλεκτρόνια του να είναι πιο επιρρεπή στο να μοιράζονται τον χώρο με ένα επιπλέον ηλεκτρόνιο, αυξάνοντας τη συγγένεια των ηλεκτρονίων.
Ατομική ακτίνα:
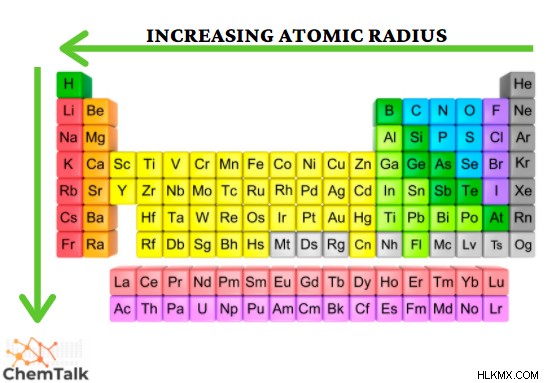
Η ατομική ακτίνα είναι ένας όρος που περιγράφει την απόσταση μεταξύ του πυρήνα ενός ατόμου και του εξώτατου κελύφους ηλεκτρονίων του. Διάφοροι παράγοντες επηρεάζουν αυτή την απόσταση. συμπεριλαμβανομένου του αριθμού ενός στοιχείου και του αριθμού των κελυφών ηλεκτρονίων. Μέσω των περιοδικών τάσεων, η ατομική ακτίνα αυξάνεται σε μέγεθος πιο αριστερά από μια περίοδο και μειώνεται προς τα κάτω σε μια ομάδα. Ακολουθώντας αυτό το μοτίβο, το καίσιο φαίνεται να έχει τη μεγαλύτερη ατομική ακτίνα.
Περιοδικές τάσεις:Περαιτέρω ανάγνωση:
Πώς να διαβάσετε τον Περιοδικό Πίνακα
Η δομή ενός ατόμου
Τάση ατομικής ακτίνας
Ατομικός αριθμός