Ionic Radius Trends
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μυηθείτε στις τάσεις ιοντικής ακτίνας στον περιοδικό πίνακα των στοιχείων. Θα εξοικειωθείτε επίσης με τις έννοιες που συμβάλλουν στην ιοντική ακτίνα, συμπεριλαμβανομένου του τρόπου εύρεσης της.
Θέματα που καλύπτονται σε άλλα άρθρα
- Μέταλλα και μη μέταλλα του περιοδικού πίνακα
- Τάσεις ατομικής ακτίνας
- Πώς να γράψετε μια διαμόρφωση ηλεκτρονίων
- Τι είναι τα ηλεκτρόνια σθένους
- Τι είναι η ενέργεια πλέγματος
Λεξιλόγιο
- Ατομική ακτίνα – Η ατομική ακτίνα ενός χημικού στοιχείου είναι ένα μέτρο του μεγέθους του ατόμου του, συνήθως η μέση ή τυπική απόσταση από το κέντρο του πυρήνα στο εξώτατο απομονωμένο ηλεκτρόνιο.
- Ιωνική ακτίνα – είναι η ακτίνα ενός μονοατομικού ιόντος σε μια ιοντική κρυσταλλική δομή. Αν και ούτε τα άτομα ούτε τα ιόντα έχουν αιχμηρά όρια, αντιμετωπίζονται σαν να ήταν σκληρές σφαίρες με ακτίνες τέτοιες ώστε το άθροισμα των ιοντικών ακτίνων του κατιόντος και του ανιόντος να δίνει την απόσταση μεταξύ των ιόντων σε ένα κρυσταλλικό πλέγμα.
- Ηλεκτρόνια σθένους – τα ηλεκτρόνια στο εξωτερικό περίβλημα, ή ενεργειακό επίπεδο, ενός ατόμου.
Τι είναι ένα ιόν;
Το ιόν είναι ένα άτομο που φέρει θετικό ή αρνητικό ηλεκτρικό φορτίο. Όταν ένα άτομο στον περιοδικό πίνακα χάνει ένα ηλεκτρόνιο γίνεται κατιόν. Αντίθετα, όταν ένα άτομο στον περιοδικό πίνακα αποκτά ένα ηλεκτρόνιο γίνεται ανιόν.
Τα περισσότερα μέταλλα στον περιοδικό πίνακα τείνουν να σχηματίζουν κατιόντα. Για παράδειγμα, τα μέταλλα της ομάδας 1Α (Μέταλλα Αλκαλίων) έχουν όλα φορτίο +1 που σημαίνει ότι θέλουν να δώσουν ένα ηλεκτρόνιο. Τα αμέταλλα τείνουν να γίνονται ανιόντα.
Ιονική ακτίνα
Εξ ορισμού, μια ιοντική ακτίνα είναι η απόσταση του εξωτερικού κελύφους των ηλεκτρονίων (κελύφος σθένους) από τον πυρήνα ενός ιόντος. Έτσι στην παρακάτω εικόνα η ιοντική ακτίνα θα βρεθεί μετρώντας την απόσταση μεταξύ των κίτρινων και μπλε πρωτονίων στον πυρήνα. Στα κόκκινα ηλεκτρόνια στο εξώτατο τροχιακό. Αυτή είναι μια καλή απεικόνιση του τρόπου με τον οποίο μπορεί να μετρηθεί η ακτίνα, αλλά αυτό είναι απίθανο να είναι ακριβές επειδή τα όρια των τροχιακών είναι αρκετά ασαφή.
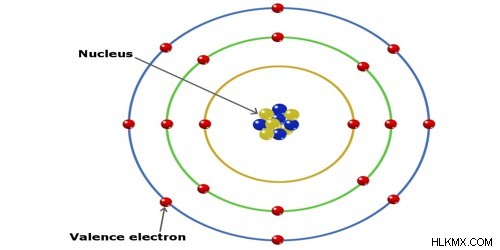
Η ιοντική ακτίνα ενός ιόντος μετριέται όταν το άτομο βρίσκεται σε δομή κρυσταλλικού πλέγματος. Η ιοντική ακτίνα είναι το ήμισυ της απόστασης μεταξύ δύο ιόντων που μόλις αγγίζουν το ένα το άλλο. Όπως αναφέρθηκε παραπάνω, τα όρια του κελύφους των φλοιών ηλεκτρονίων είναι δύσκολο να διαβαστούν. Έτσι τα ιόντα ενός ατόμου αντιμετωπίζονται σαν να ήταν σφαίρες. Η ιοντική ακτίνα μπορεί εύκολα να είναι λίγο μικρότερη ή μεγαλύτερη από την ατομική ακτίνα, η οποία είναι η ακτίνα που έχει ένα ουδέτερο άτομο του στοιχείου.
Εύρεση ιοντικής ακτίνας
Δεδομένου ότι τα ιόντα τείνουν να υπάρχουν σε δεσμούς, η ιοντική ακτίνα μπορεί να βρεθεί μέσω του ιοντικού δεσμού μεταξύ δύο ατόμων. Επιπλέον, η ιοντική ακτίνα είναι δύσκολο να μετρηθεί καθώς εξαρτάται από τους ποικίλους παράγοντες του περιβάλλοντος στο οποίο βρίσκεται το ιόν. Εξαρτάται από τον αριθμό των ατόμων, ιόντων ή μορίων που ένα κεντρικό άτομο ή ιόν κρατά ως πλησιέστερους γείτονές του σε ένα σύμπλοκο ή μια ένωση συντονισμού. Εξαρτάται επίσης από την κατάσταση σπιν του ιόντος. Η ιοντική ακτίνα υπολογίζεται γενικά με την εκτίμηση της απόστασης μεταξύ των δύο πυρήνων και τη διαίρεση της σύμφωνα με τα ατομικά μεγέθη. Η ιοντική ακτίνα γενικά μετριέται σε πικόμετρο (pm) ή νανόμετρο (nm).

Κατιόντα Vs. Ανιόντα
Επειδή τα κατιόντα χάνουν ηλεκτρόνια από το κέλυφος σθένους, συχνά έχουν μικρότερες ιοντικές ακτίνες από το μητρικό τους ουδέτερο άτομο. Αντίστροφα για τα ανιόντα, καθώς τα ανιόντα αποκτούν ηλεκτρόνια στο εξωτερικό περίβλημα, συνήθως θα έχουν μεγαλύτερες ακτίνες από το μητρικό τους ουδέτερο άτομο.
Πρώην . Η ατομική ακτίνα του νατρίου (Na) είναι 190 pm, αλλά η ιοντική ακτίνα του νατρίου (Na) είναι μόνο 116 pm.
Πρώην . Η ατομική ακτίνα του ατόμου χλωρίου (Cl) είναι 79 pm και η ιοντική ακτίνα του ιόντος χλωρίου (Cl) είναι 167 pm.
Τάσεις ιοντικής ακτίνας στον περιοδικό πίνακα
Ιονική ακτίνα και ομάδα
Καθώς μετακινείστε προς τα κάτω στον περιοδικό πίνακα προστίθενται επιπλέον ηλεκτρόνια, τα οποία με τη σειρά τους προκαλούν την αύξηση της ιοντικής ακτίνας.
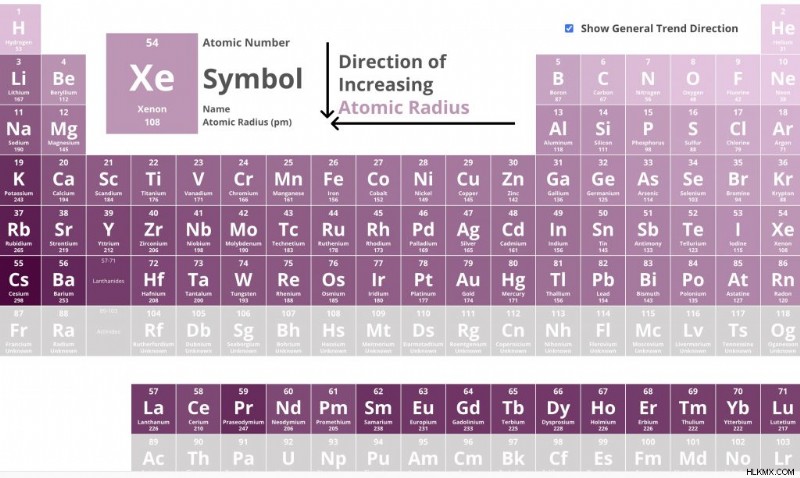
Κοιτάξτε την ομάδα 2 στον περιοδικό πίνακα (Μέταλλα Αλκαλικής Γης)
- Ιονική ακτίνα βηρυλλίου – 31 μ.μ.
- Ιονική ακτίνα μαγνησίου – 65 μ.μ.
- Ιονική ακτίνα ασβεστίου – 99 μ.μ.
- Ιονική ακτίνα στροντίου – 113 μ.μ.
- Ιονική ακτίνα βαρίου – 135 μ.μ.
Σε συμφωνία με την τάση αύξησης της ατομικής ακτίνας καθώς μετακινείστε προς τα κάτω στον περιοδικό πίνακα.
Ιονική ακτίνα και περίοδος
Καθώς μετακινείστε στον περιοδικό πίνακα προστίθενται περισσότερα ηλεκτρόνια, πρωτόνια και νετρόνια. Άρα θα ήταν λογικό να αυξηθεί η ακτίνα, αλλά δεν συμβαίνει. Αυτό συμβαίνει επειδή καθώς μετακινείστε σε μια σειρά στον περιοδικό πίνακα, η ιοντική ακτίνα μειώνεται για τα μέταλλα που σχηματίζουν κατιόντα. Η ιοντική ακτίνα αυξάνεται για τα μη μέταλλα καθώς μειώνεται το ενεργό πυρηνικό φορτίο.
Μετακίνηση κατά μήκος του περιοδικού πίνακα από κάλιο (K)
- Ιονική ακτίνα καλίου (Κ) – 137 μ.μ.
- Ακτίνα ιοντικού ασβεστίου (Ca) – 99 μ.μ.
- Ιονική ακτίνα σκανδίου (Sc) – 87 μ.μ.
Παρατηρήστε καθώς μετακινείστε προς τα δεξιά στον περιοδικό πίνακα, το μέγεθος της ιοντικής ακτίνας μειώνεται.




