Ο νόμος του Hess
Βασικές έννοιες
Τι είναι λοιπόν ο νόμος του Hess; Σε αυτό το σεμινάριο, θα μυηθείτε στον Νόμο του Hess , καθώς και η εξίσωση που συνδυάζεται με αυτήν την έννοια. Επιπλέον, θα κατακτήσετε περαιτέρω αυτήν την έννοια εξετάζοντας ορισμένα παραδείγματα προβλημάτων.
Θέματα που καλύπτονται σε άλλα άρθρα
- Τι είναι η χημική αντίδραση
- Πώς να εξισορροπήσετε τις εξισώσεις
- Gibbs Free Energy
- Ειδική θερμότητα
- Καθαρή ιοντική εξίσωση
- Εισαγωγή Θερμοχημείας
Τι είναι ο νόμος του Hess;
Ο Ρώσος χημικός και φυσικός Germain Hess ανέπτυξε τις έννοιες της θερμοχημείας και της φυσικής χημείας. Εισήγαγε την έννοια που είναι γνωστή ως Νόμος του Hess της σταθερής θερμότητας αθροίσματος ή ο νόμος του Hess για συντομία.
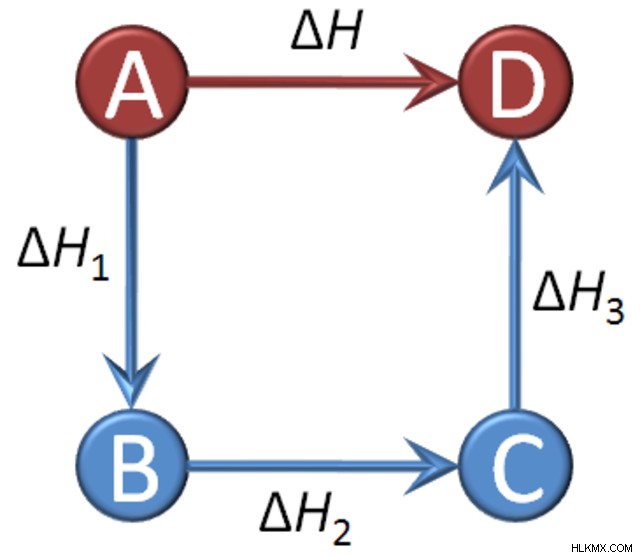
Αυτός ο νόμος έχει να κάνει με την καθαρή ενθαλπία σε μια αντίδραση. Συνολικά, δηλώνει ότι η συνολική μεταβολή της ενθαλπίας μιας αντίδρασης είναι το άθροισμα όλων των αλλαγών, ανεξάρτητα από τον αριθμό των σταδίων ή σταδίων της αντίδρασης (δηλαδή η καθαρή ενθαλπία και ο αριθμός των βημάτων σε μια αντίδραση είναι ανεξάρτητα μεταξύ τους). Οι ιδέες αυτού του νόμου φαίνονται σε όλη την επιστήμη, όπως στην αρχή της διατήρησης της ενέργειας ή στον πρώτο νόμο της θερμοδυναμικής και στη δήλωση ότι η ενθαλπία είναι συνάρτηση κατάστασης.
Υπάρχουν ορισμένες απαιτήσεις που πρέπει να ακολουθήσει η αντίδραση για να χρησιμοποιηθεί ο νόμος του Hess. Για παράδειγμα, εάν υπάρχουν πολλά βήματα στις αντιδράσεις, κάθε εξίσωση πρέπει να είναι σωστά ισορροπημένη. Επίσης, όλα τα στάδια της αντίδρασης πρέπει να ξεκινούν και να τελειώνουν σε σταθερές θερμοκρασίες και πιέσεις προκειμένου να διατηρούνται σταθερές οι συνθήκες αντίδρασης.
Εξίσωση του νόμου του Hess
Για να βάλουμε αυτόν τον ορισμό σε μαθηματικούς όρους, εδώ είναι η εξίσωση του νόμου του Hess:
∆Hnet =∑∆Hr
καθαρή μεταβολή ενθαλπίας =∆Hκαθαρό
το άθροισμα όλων των βημάτων μεταβολής της ενθαλπίας =∆Hr
Αλλαγή ενθαλπίας
Η μεταβολή της ενθαλπίας, ΔΗ, μπορεί να οριστεί ως η ποσότητα θερμότητας που απορροφάται ή απελευθερώνεται κατά τη διάρκεια μιας αντίδρασης. Σε κάθε μεμονωμένο βήμα μιας αντίδρασης πολλαπλών σταδίων, υπάρχει μια τιμή ενθαλπίας έναρξης και λήξης - η διαφορά μεταξύ τους είναι η μεταβολή της ενθαλπίας. Αυτή η τιμή μπορεί να είναι είτε αρνητική εάν η θερμότητα απορροφήθηκε, είτε θετική εάν η θερμότητα απελευθερώθηκε. Εάν αθροίσετε όλες τις αλλαγές ενθαλπίας κάθε σταδίου αντίδρασης (∆Hr ), έχετε καθαρή μεταβολή ενθαλπίας, η οποία βρίσκεται βρίσκοντας τη διαφορά μεταξύ της ενθαλπίας του τελικού προϊόντος και της ενθαλπίας του αρχικού αντιδραστηρίου (ΔHnet ). Αυτός είναι ο νόμος του Hess!
Παράδειγμα προβλημάτων του νόμου του Hess
Τώρα που καταλαβαίνουμε την έννοια και την εξίσωση του νόμου του Hess, ας επεκτείνουμε τις γνώσεις μας με προβλήματα εξάσκησης. Αυτά τα προβλήματα λέξεων μπορεί να ζητούν κάποιο χειρισμό των αντιδράσεων (δηλαδή αλλαγή της κατεύθυνσης της εξίσωσης, πολλαπλασιασμός, διαίρεση), αλλά η γενική ιδέα είναι η ίδια για όλα τα προβλήματα του νόμου του Hess. Ας δούμε μερικά παραδείγματα παρακάτω!
Παράδειγμα προβλήματος 1
Βρείτε την καθαρή μεταβολή της ενθαλπίας (∆Hnet ) της παρακάτω αντίδρασης, δεδομένων των σταδίων αντίδρασης και των τιμών ΔH τους.
Συνολική αντίδραση:N2 H4(l) +H2(g) → 2NH3 (g)
(i) N2 H4(l) + CH4 O(l) → CH2 O(g) + N2(g) + 3H2(g) ∆H=– 37kJ/mol
(ii) N2(g) + 3H2(g) → 2NH3(g) ∆H=-46kJ/mol
(iii) CH4 O(l) → CH2 O(g) + H2(g) ∆H=-65kJ/mol
1. Βεβαιωθείτε ότι τα βήματα είναι (α) ισορροπημένα (β) στη σωστή κατεύθυνση και (γ) έχουν ως αποτέλεσμα τη συνολική αντίδραση.
Για να βεβαιωθείτε ότι όλα τα βήματα που δίνονται είναι απαραίτητα για τη συνολική αντίδραση, προσθέστε τις εξισώσεις και διαγράψτε επαναλαμβανόμενες ενώσεις για να δημιουργήσετε μια συνολική εξίσωση.
Ωστόσο, αν κάνουμε αυτό το βήμα με τις αντιδράσεις ως έχουν, δεν καταλήγουμε στη σωστή αντίδραση γιατί έχουμε ενώσεις στη λάθος πλευρά καθώς και επιπλέον ενώσεις. Εξαιτίας αυτού, μπορούμε να αναλύσουμε εάν ένα ή περισσότερα από ένα βήματα πηγαίνουν προς την αντίθετη κατεύθυνση.
Εφόσον η αντίδραση (i) είναι η μόνη με N2H4(l), που είναι αντιδρών στη συνολική εξίσωση, υποτίθεται ότι πηγαίνει στη σωστή κατεύθυνση. Στη συνέχεια, η αντίδραση (ii) έχει το προϊόν 2ΝΗ3(g) στη δεξιά πλευρά, έτσι ώστε η εξίσωση να παραμένει ίδια. Στην παραπάνω προσπάθεια να βρεθεί η συνολική εξίσωση, το αέριο υδρογόνο από τις εξισώσεις (i) και (ii) αλληλοεξουδετερώνονται, που σημαίνει ότι το αέριο υδρογόνο από την αντίδραση (iii) είναι το μόνο που έχει απομείνει για να φτάσει στη συνολική εξίσωση, η οποία ανήκει στα αριστερά. Εξαιτίας αυτού, μπορούμε να αναστρέψουμε την εξίσωση των αντιδρώντων και των προϊόντων για να πάμε προς τα πίσω. Ωστόσο, επειδή η αντίδραση είναι αντίθετη, η ενθαλπία γίνεται επίσης το «αντίθετο». Εάν αλλάξετε την κατεύθυνση μιας αντίδρασης, το αντίστροφο της ενθαλπίας γίνεται η νέα ενθαλπία.
Τα βήματα της "νέας" εξίσωσης μοιάζουν με αυτό:
(i) N2 H4(l) + CH4 O(l) → CH2 O(g) + N2(g) + 3H2(g) ∆H=– 37kJ/mol
(ii) N2(g) + 3H2(g) → 2NH3(g) ∆H=-46kJ/mol
(iii) CH2 O(g) + H2(g) → CH4 O(l) ∆H=+65kJ/mol
Με την αντίδραση (iii) αλλάζει η μέθοδος προσθήκης όλων των εξισώσεων οδηγεί στη σωστή συνολική αντίδραση:
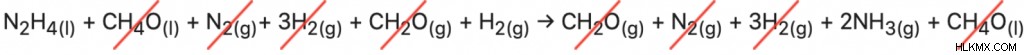
N2 H4(l) +H2(g) → 2NH3 (g)
2. Βρείτε την Καθαρή Αλλαγή Ενθαλπίας
Τώρα που έχουμε τις επίσημες τιμές ενθαλπίας, μπορούμε να χρησιμοποιήσουμε την εξίσωση του νόμου του Hess για να λύσουμε.
∆Hnet =∑∆Hr =(-37 kJ/mol) + (-46 kJ/mol) + 65 kJ/mol =-18 kJ/mol
Παράδειγμα προβλήματος 2
Βρείτε την καθαρή μεταβολή της ενθαλπίας (∆Hnet ) της παρακάτω αντίδρασης, δεδομένων των σταδίων αντίδρασης και των τιμών ΔH τους.
Συνολική αντίδραση:CS2(l) + 3O2(g) → CO2(g) + 2SO2(g)
(i) C(s) + O2(g) → CO2(g) ∆H=-395 kJ/mol
(ii) S(s) + O2(g) → SO2(g) ∆H=-295 kJ/mol
(iii) C(s) + 2S(s) → CS2(l) ∆H=+90 kJ/mol
1. Βεβαιωθείτε ότι τα βήματα είναι (α) ισορροπημένα (β) στη σωστή κατεύθυνση και (γ) έχουν ως αποτέλεσμα τη συνολική αντίδραση.
Αρχικά, χρησιμοποιώντας τις ίδιες μεθόδους όπως παραπάνω, ελέγχουμε αν όλες οι αντιδράσεις βημάτων πηγαίνουν στη σωστή κατεύθυνση για να κάνουμε τη σωστή αντίδραση. Η αντίδραση (i) έχει το επιθυμητό CO2(g) προϊόν, που σημαίνει ότι μπορεί να παραμείνει αμετάβλητο. Η αντίδραση (iii) έχει CS2(l) ως προϊόν, αλλά είναι ένα επιθυμητό αντιδραστήριο στη συνολική αντίδραση. Επομένως, αντιστρέφουμε αυτήν την αντίδραση και χρησιμοποιούμε την αντίστροφη τιμή ∆H.
Όσον αφορά την αντίδραση (ii), η κατεύθυνση είναι σωστή επειδή O2(g) ως αντιδρών και SO2(g) ως προϊόν φαίνονται και τα δύο στην επιθυμητή αντίδραση. Ωστόσο, όταν προσθέτουμε τις εξισώσεις μαζί, ένα O2(g) και ένα SO2(g) λείπουν (υπάρχει επίσης ένα επιπλέον S(α) που πρέπει να ακυρωθεί). Αυτό μπορεί να διορθωθεί πολλαπλασιάζοντας την αντίδραση (ii) με έναν συντελεστή 2. Εάν το πολλαπλασιάσετε (ή το διαιρέσετε), πρέπει επίσης να πολλαπλασιάσετε (ή να διαιρέσετε) την τιμή ΔH με τον ίδιο συντελεστή.
(i) C(s) + O2(g) → CO2(g) ∆H=-395 kJ/mol
(ii) 2S(α) + 2O2(g) → 2SO2(g) ∆H=-590 kJ/mol
(iii) CS2(l) → C(s) + 2S(s) ∆H=-90 kJ/mol
Με χειρισμό των αντιδράσεων (ii) και (iii), η μέθοδος προσθήκης όλων των εξισώσεων οδηγεί στη σωστή συνολική αντίδραση:
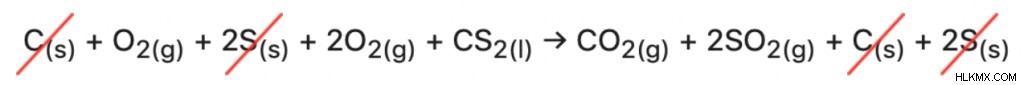
CS2(l) + 3O2(g) → CO2(g) + 2SO2(g)
2. Βρείτε την Καθαρή Αλλαγή Ενθαλπίας
Τώρα που έχουμε τις επίσημες τιμές ενθαλπίας, μπορούμε να χρησιμοποιήσουμε την εξίσωση του νόμου του Hess για να λύσουμε.
∆Hnet =∑∆Hr =(-395 kJ/mol) + (-590 kJ/mol) + (-90 kJ/mol) =-1075 kJ/mol
Περαιτέρω ανάγνωση
- Προβολές Newman
- Υπολογισμός ποσοστού κατά βάρος
- Υπολογισμός ποσοστού απόδοσης
- Αποχώρηση από την ομάδα




