Εξίσωση Nernst
Τι είναι η εξίσωση Nernst;
Η εξίσωση Nernst υπολογίζει το δυναμικό του ηλεκτροχημικού στοιχείου σε οποιαδήποτε γνωστή θερμοκρασία, πίεση και συγκέντρωση. Η εξίσωση συσχετίζει το δυναμικό μείωσης του κυττάρου σε μια μη τυπική κατάσταση με αυτό των τυπικών συνθηκών (298K, 1 atm και συγκέντρωση 1 M).
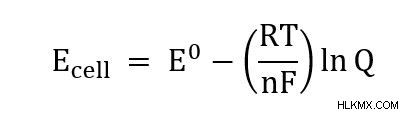
- EΚελί =δυναμικό κυττάρου
- E =Δυναμικό κυψέλης υπό τυπικές συνθήκες
- R =Καθολική σταθερά αερίου (8,314 J/(mol*K))
- T =Θερμοκρασία
- n =Αριθμός ηλεκτρονίων που μεταφέρθηκαν στην αντίδραση
- F =σταθερά Faraday (96485 C/mol)
- Q =Πηλίκο αντίδρασης
Το Q είναι το ίδιο με τη σταθερά ισορροπίας (K) εκτός από το ότι δεν είναι απαραίτητα σε ισορροπία. Είναι λογικό να χρησιμοποιήσουμε το Q, καθώς προσπαθούμε να βρούμε μη τυπικά δυναμικά κελιών.
Η εξίσωση μπορεί να χρησιμοποιηθεί για την εύρεση του δυναμικού των αντιδράσεων μισού κυττάρου ή των δυναμικών κυττάρων για διάφορα ηλεκτροχημικά κύτταρα.
Η εξίσωση φαίνεται επίσης γραμμένη σε πολλές άλλες μορφές όπου ο όρος RT/nF απλοποιείται σε μια σταθερά. Για παράδειγμα, για να γίνει η εξίσωση πιο παρόμοια με την εξίσωση pH, το φυσικό ημερολόγιο μπορεί να αλλάξει σε log.

Για κελιά στους 25C, η εξίσωση μπορεί να απλοποιηθεί σε
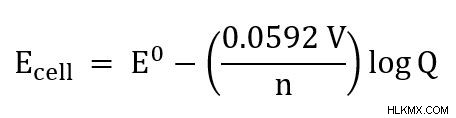
Η εξίσωση Nernst είναι επίσης χρήσιμη για τον προσδιορισμό της αύξησης του δυναμικού κυττάρου για μια αύξηση στη συγκέντρωση ενός αντιδραστηρίου. Εάν το Q είναι 1, τότε το δυναμικό κυψέλης θα είναι το ίδιο με το τυπικό δυναμικό κυψέλης. Οποιαδήποτε άλλη τιμή του Q θα έχει ως αποτέλεσμα το δυναμικό του κελιού να είναι διαφορετικό από το τυπικό. Μια τιμή Q πάνω από 1 σημαίνει ότι το δυναμικό του κελιού θα είναι μικρότερο από το τυπικό. Μια τιμή Q μικρότερη από 1 σημαίνει ότι θα είναι υψηλότερη από το τυπικό.
Όταν το κυτταρικό δυναμικό γίνεται πιο θετικό, η αντίδραση είναι πιο πιθανό να λάβει χώρα.
Παραγωγή της εξίσωσης Nernst
Η εξίσωση Nernst προέρχεται από την ελεύθερη ενέργεια Gibbs.
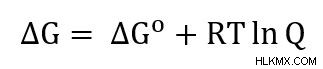
Μπορούμε να ξαναγράψουμε αυτήν την εξίσωση χρησιμοποιώντας τους ορισμούς ΔG =-nFE και ΔG =-nFE.
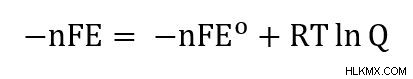
Για απλοποίηση, διαιρούμε κάθε πλευρά με -nF και καταλήγουμε στην εξίσωση Nernst όπως γράφεται συνήθως.
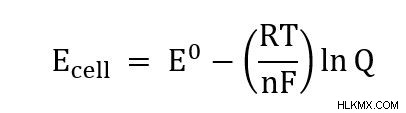
Παράδειγμα προβλήματος με χρήση της εξίσωσης
Πρόβλημα :Έχετε ένα ηλεκτροχημικό στοιχείο με μόλυβδο (Pb) και ασήμι (Ag) που λειτουργεί στους 25C. Η αντίδραση του κυττάρου παρατίθεται παρακάτω.
Pb(s) + 2 Ag (aq) –> Pb(aq) + 2Ag(s)
Υπολογίστε το δυναμικό κυψέλης όταν [Ag+] =0,75 M και [Pb2+] =0,1 M. Το τυπικό δυναμικό κυψέλης είναι 0,93 V.
Εργασμένη λύση:
Πρώτα, γράψτε την αντίδραση που συμβαίνει και βρείτε το τυπικό δυναμικό κυττάρου (Ε) εάν δεν έχει ήδη δοθεί. Σε αυτή την περίπτωση, η αντίδραση και το δυναμικό των κυττάρων δίνονται στο πρόβλημα. Για μια υπενθύμιση σχετικά με τον τρόπο εύρεσης του τυπικού δυναμικού κυψέλης, ανατρέξτε στον οδηγό για τα ηλεκτροχημικά κύτταρα.
Δεύτερον, αρχίστε να συνδέετε δεδομένες ή γνωστές τιμές στην εξίσωση Nernst. Σε αυτό το πρόβλημα, μπορούμε να συνδέσουμε τα n, Q και E. Η σταθερά αερίου (R) και η σταθερά Faraday (F) είναι σταθερές που απλοποιούνται στην τιμή των 0,0592 V. Αυτή η απλοποίηση είναι δυνατή επειδή εργαζόμαστε στους 25C.
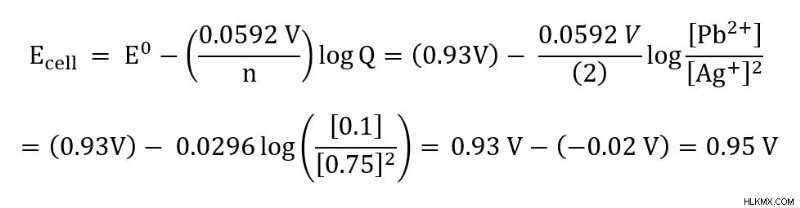
Υπενθύμιση ότι για το Q, τα στερεά συστατικά της αντίδρασης δεν περιλαμβάνονται στην τιμή. Έτσι, σε αυτό το παράδειγμα, τα Pb(s) και Ag(s) δεν περιλαμβάνονται. Η τιμή n μας προέρχεται από το να δούμε ότι στην αντίδρασή μας μεταφέρονται 2 γραμμομόρια ηλεκτρονίων.
Ελέγξτε τις μονάδες σας όταν αντιμετωπίζετε προβλήματα για να βεβαιωθείτε ότι καταλήγετε στις σωστές μονάδες, ειδικά εάν δεν μπορείτε να χρησιμοποιήσετε τον απλοποιημένο συντελεστή για εργασία στους 25 C.
Περιορισμοί της εξίσωσης Nernst
Αν και οι περιορισμοί της εξίσωσης Nernst δεν μπαίνουν στο παιχνίδι πολύ συχνά, υπάρχουν ορισμένες υποθέσεις που γίνονται με την εξίσωση. Ακολουθούν ορισμένες περιπτώσεις στις οποίες η εξίσωση Nernst καθίσταται ανακριβής.
- Όταν οι συγκεντρώσεις είναι εξαιρετικά υψηλές, η εξίσωση Nernst γίνεται ανακριβής. Όταν οι συγκεντρώσεις των αντιδραστηρίων ή των προϊόντων γίνονται εξαιρετικά υψηλές, χρησιμοποιούνται πειράματα για τον προσδιορισμό των δυνατοτήτων.
- Σε πολύ πολύ αραιές λύσεις, το προβλεπόμενο δυναμικό μπορεί να φτάσει στο άπειρο, το οποίο δεν είναι ρεαλιστικό και θα πρέπει να αγνοηθεί.
- Η εξίσωση δεν μπορεί να χρησιμοποιηθεί όταν υπάρχει ρεύμα που διαρρέει το κελί. Το ρεύμα αλλάζει τη δραστηριότητα (αποτελεσματική συγκέντρωση) των ιόντων. Αυτό το αποτέλεσμα κάνει την εξίσωση να είναι ανακριβής.
Διασκεδαστικά γεγονότα:
- Ο Walther Hermann Nernst (1864-1941), ένας Γερμανός χημικός, ανέπτυξε την εξίσωση.
- Ο Nernst έλαβε το Νόμπελ Χημείας το 1920 για την εργασία που έκανε στη θερμοχημεία.
- Μια άλλη κοινώς γνωστή ανακάλυψη του Nernst είναι ο τρίτος νόμος της θερμοδυναμικής.
- Τα ηλεκτροχημικά δυναμικά κυψελών είναι μία από τις κύριες εφαρμογές της εξίσωσης Nernst. Τα ηλεκτροχημικά κύτταρα είναι αυτά που οδηγούν τους περισσότερους τύπους μπαταριών! Αυτά τα κελιά μπορούν επίσης να χρησιμοποιηθούν για την επικάλυψη λεπτών στρωμάτων υλικών σε άλλες επιφάνειες, όπως η επίστρωση χρυσού σε κοσμήματα.
Περαιτέρω ανάγνωση
- Ηλεκτρολυτικά κύτταρα και ηλεκτρόλυση
- Βολταϊκά στοιχεία και γαλβανικά στοιχεία
- Τυπικές δυνατότητες μείωσης
- Σταθερά ισορροπίας
- Gibbs Free Energy
- Κίνηση Brownian




