Κατακρήμνιση &Αντιδράσεις Κατακρήμνισης στη Χημεία
Τι είναι το ίζημα;
Ο ορισμός του ιζήματος είναι ένα στερεό που καθιζάνει (βγαίνει από) διάλυμα. Στη χημεία, το στερεό σχηματίζεται συνήθως λόγω μιας αντίδρασης καθίζησης που λαμβάνει χώρα. Στερεό μπορεί επίσης να σχηματιστεί λόγω αλλαγής της θερμοκρασίας ή οποιασδήποτε άλλης περιβαλλοντικής αλλαγής που επηρεάζει τη διαλυτότητα της ένωσης. Η στερεά ένωση μπορεί να παραμείνει εναιωρημένη σε διάλυμα ή να πέσει στον πυθμένα του δοχείου.
Το ίζημα μπορεί επίσης να χρησιμοποιηθεί ως ρήμα στη χημεία. Η κατακρήμνιση είναι η πράξη μιας ένωσης που πηγαίνει από το να είναι υδατικό σε ένα διάλυμα στο σχηματισμό ενός στερεού προϊόντος. Αυτές μπορούν επίσης να ονομαστούν αντιδράσεις καθίζησης.
Τι είναι η αντίδραση καθίζησης;
Ο ορισμός της αντίδρασης καθίζησης είναι όταν δύο (ή περισσότερα) διαλυτά άλατα αντιδρούν για να σχηματίσουν ένα αδιάλυτο προϊόν. Τα αντιδρώντα είναι ιόντα στο διάλυμα. Το αδιάλυτο προϊόν αναφέρεται ως ίζημα. Ένα άλας είναι μια ιοντική ένωση.

Συχνά, μια αντίδραση καθίζησης είναι μια «αντίδραση διπλής αντικατάστασης». Δηλαδή όταν υπάρχουν δύο άλατα που είναι διαλυτά και όταν το κατιόν του ενός συνδέεται με το ανιόν του άλλου σχηματίζει ένα στερεό προϊόν που δεν είναι διαλυτό. Το άλλο ζεύγος κατιόντων και ανιόντων μπορεί να είναι ή να μην είναι διαλυτό. Αυτός ο τύπος αντίδρασης έχει την ακόλουθη μορφή.
AB(aq) + CD(aq) –> AD(s) + BC(s or aq)
Για να είναι μια αντίδραση ιζήματος, είτε το AD είτε το CB θα είναι ένα αδιάλυτο στερεό. Το AB και το CD είναι και οι δύο ιοντικές ενώσεις υδατικές σε διάλυμα.
Στις αντιδράσεις καθίζησης, το σχηματιζόμενο ίζημα μπορεί να παραμείνει εναιωρημένο σε διάλυμα ή μπορεί να βυθιστεί στον πυθμένα. Τα στερεά σωματίδια μπορούν στη συνέχεια να αφαιρεθούν από το διάλυμα με διάφορα μέσα όπως διήθηση, απόχυση, φυγοκέντρηση. Το υγρό που μένει πίσω αναφέρεται ως υπερκείμενο.
Αυτές οι αντιδράσεις χρησιμοποιούνται συνήθως για να βοηθήσουν στον προσδιορισμό των ιόντων στο διάλυμα.
Πώς να προσδιορίσετε μια αντίδραση βροχόπτωσης
Μια αντίδραση καθίζησης θα έχει πάντα ένα στερεό προϊόν. Τα αντιδρώντα είναι συνήθως δύο ή περισσότερα ιοντικά υδατικά μόρια. Το προϊόν πρέπει να περιλαμβάνει ένα συμπαγές προϊόν.
Η πιο γενική μορφή αντίδρασης καθίζησης είναι:
A(aq) + B(aq) –> AB(s)
Ag(aq) + Cl(aq) –> AgCl(s)
Τα αντιδρώντα πρέπει να είναι ιοντικές ενώσεις σε διάλυμα. Έτσι η αντίδραση που θα περιλαμβάνει όλα τα συστατικά θα είναι:
AC(aq) + BD(aq) –> AD(s) + B(aq) + C(aq)
AgNO3 (υδατ.) + NaCl (υδατ.) –> AgCl(s) + Na(υδατ.) + NO3 (aq)
Επειδή τα αντιδρώντα είναι υδατικά και θέλουμε να γνωρίζουμε τα ιόντα σε διάλυμα, είναι συνηθισμένο να γράφουμε την αντίδραση ως προς τα ιόντα. Αυτή η μορφή ονομάζεται πλήρης ιοντική εξίσωση:
Ag(aq) + NO3 (aq) + Na(aq) + Cl(aq) –> AgCl(s) + Na(aq) + NO3 (aq)
Για να απλοποιήσετε περαιτέρω αυτήν την εξίσωση, απαλλαγείτε από κάθε ιόν που εμφανίζεται τόσο στην πλευρά του αντιδρώντος όσο και στο προϊόν, καθώς αυτό υποδηλώνει ότι δεν αποτελούν μέρος της αντίδρασης. Αυτά τα ιόντα ονομάζονται επίσης ιόντα θεατή. Αυτό που απομένει ονομάζεται καθαρή ιοντική εξίσωση.
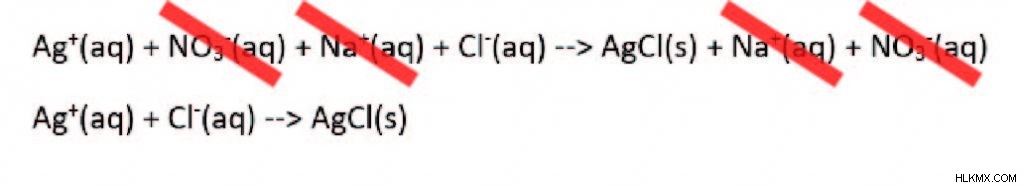
Οι καθαρές ιοντικές εξισώσεις πρέπει να είναι ισορροπημένες για να είναι ακριβείς. Τόσο το φορτίο όσο και ο αριθμός των ατόμων κάθε στοιχείου πρέπει να είναι ισορροπημένοι.
Τι είναι οι κανόνες διαλυτότητας;
Αυτές είναι γενικές οδηγίες ή κανόνες σχετικά με το ποιες ενώσεις θα σχηματίσουν ένα ίζημα. Ένας εξαιρετικός πόρος είναι η εύρεση ενός καλού πίνακα διαλυτότητας ή ενός διαγράμματος διαλυτότητας. Υπάρχουν επίσης ορισμένοι γενικοί κανόνες που μπορείτε να μάθετε για τη διαλυτότητα διαφορετικών ενώσεων.
- Τα αλκαλικά μέταλλα (Ομάδα Ι) είναι διαλυτά.
- Τα νιτρικά, τα οξικά, τα χλωρικά και τα υπερχλωρικά είναι γενικά διαλυτά.
- Τα χλωρίδια, τα βρωμιούχα και τα ιωδίδια είναι διαλυτά εκτός εάν με Ag, Pb και Hg2 .
- Τα περισσότερα άλατα αργύρου είναι αδιάλυτα. Οι δύο κύριες εξαιρέσεις είναι ο οξικός άργυρος και ο νιτρικός άργυρος.
- Τα θειικά είναι διαλυτά, εκτός από τα Ca, Sr, Ba, Pb και Ag.
- Τα υδροξείδια είναι αδιάλυτα εκτός από τα αλκαλικά μέταλλα. Τα υδροξείδια είναι ελαφρώς διαλυτά με τα μέταλλα των αλκαλικών γαιών.
- Τα σουλφίδια είναι αδιάλυτα εκτός από τα μέταλλα των αλκαλίων και των αλκαλικών γαιών.
- Ανθρακικά, χρωμικά, φωσφορικά και φθοριούχα άλατα είναι όλα αδιάλυτα εκτός από τα αλκαλικά μέταλλα και το αμμώνιο.
Ένα πλήρες διάγραμμα διαλυτότητας και περιγραφή του ποιες ενώσεις είναι διαλυτές μπορείτε να βρείτε στο σεμινάριο Κανόνων διαλυτότητας.
Για να μάθετε πώς να ονομάζετε αυτές τις ενώσεις, διαβάστε το σεμινάριο Naming Ionic Compounds!
Χρήσεις αντιδράσεων βροχόπτωσης και παραδείγματα πραγματικής ζωής
Οι αντιδράσεις καθίζησης χρησιμοποιούνται συνήθως για να προσδιοριστεί εάν ορισμένα ιόντα υπάρχουν σε ένα διάλυμα. Για παράδειγμα, για να προσδιοριστεί εάν υπάρχει μόλυβδος (Pb) στο διάλυμα, θα μπορούσε να προστεθεί ένα διάλυμα που περιέχει χλωρίδια ή υδροξείδια. Το ηλεκτρόδιο θα καθιζάνει είτε ως PbCl2 ή Pb(OH)2 και υποδεικνύουν ότι υπάρχει μόλυβδος. Επιπλέον, αυτές οι δοκιμές χρησιμοποιούνται συνήθως σε εργαστήρια χημείας. Για αυτές τις δοκιμές, μια σειρά ενώσεων μπορεί να προστεθεί για να συμπεράνει ποια ιόντα υπάρχουν.
Η φύση δημιουργεί επίσης μερικές δροσερές δομές ιζήματος. Κοντά σε υδροθερμικές οπές βαθέων υδάτων, κατακρημνίζονται πολλά ορυκτά, ιδιαίτερα σουλφίδια, αφήνοντας πίσω τους τεράστιες καμινάδες στον πυθμένα του ωκεανού.

Προβλήματα παραδείγματος αντίδρασης κατακρήμνισης
Πρόβλημα #1
Προβλέψτε το(τα) ίζημα(α) στα ακόλουθα παραδείγματα αντιδράσεων καθίζησης.
- AgF(aq) + CaCl2 (aq)
- AgClO3 (aq) + CaI2 (aq)
- LiNO3 (aq) + Na2 CO3 (aq)
- BaCl2 (aq) + K2 SO3 (aq)
- ZnF2 και MgSO3
Απαντήσεις:
Τα πιθανά προϊόντα παρατίθενται παρακάτω. Εξετάζοντας τους κανόνες διαλυτότητας μας ή έναν πίνακα διαλυτότητας μπορούμε να ελέγξουμε ποιοι από αυτούς θα σχηματίσουν ίζημα.
- Το AgCl είναι το ίζημα. Το άλλο πιθανό προϊόν είναι το CaF2 που είναι διαλυτό.
- Το AgI είναι το ίζημα. Το άλλο πιθανό προϊόν είναι το Ca(ClO3 )2 που είναι διαλυτό.
- Χωρίς ίζημα. Τα δύο πιθανά προϊόντα είναι το LiCO3 και NaNO3 κανένα από τα οποία δεν είναι αδιάλυτο. Και τα δύο είναι διαλυτά. Επομένως, αυτό ΔΕΝ είναι στην πραγματικότητα μια αντίδραση κατακρήμνισης.
- BaSO3 είναι το ίζημα. Το άλλο πιθανό προϊόν είναι το KCl το οποίο είναι διαλυτό.
- MgF2 και ZnSO3 είναι και τα δύο ιζήματα σε αυτήν την αντίδραση.
Πρόβλημα #2
Τι θα προσθέτατε σε ένα διάλυμα για να προσδιορίσετε εάν υπάρχει Mg;
Για να προσδιορίσουμε εύκολα αν υπάρχει Mg, θέλουμε να προσθέσουμε ένα ιόν που θα καταβυθιστεί όταν δεσμευτεί με το Mg. Γνωρίζοντας τους κανόνες διαλυτότητάς μας μπορούμε να δούμε ότι F, OH, CO3 , και PO4 όλα θα προκαλούσαν ιζήματα. Δεν μπορούμε να προσθέσουμε απευθείας αυτά τα ιόντα και αντ' αυτού πρέπει να τα συνδυάσουμε με ένα κατιόν στο οποίο είναι διαλυτά για να φτιάξουμε ένα αλάτι. Υπάρχουν πολλές επιλογές για αυτήν την απαίτηση. Ορισμένες πιθανότητες είναι NaF, NH4 F, Ba(OH)2 , LiOH, Li2 CO3 , K3 PO4 , και Na3 PO4 .
Πειράματα με αντιδράσεις καθίζησης
- Πείραμα Golden Rain
- Βίντεο αντίδρασης χλωριούχου αργύρου




