Τι είναι ένας χημικός δεσμός;
Σε αυτό το άρθρο, εξετάζουμε τους τύπους δεσμών στη χημεία. Εξηγούμε τι είναι ένας χημικός δεσμός, αναφέρουμε τους τύπους χημικών δεσμών και δίνουμε παραδείγματα χημικών δεσμών. Οι δεσμοί είναι πολύ σημαντικοί στη χημεία, καθώς υπαγορεύουν πολλές από τις χημικές ιδιότητες που έχει μια ένωση.
Χημικός δεσμός
Όταν τα άτομα έλκονται μεταξύ τους και ενώνονται για να σχηματίσουν ένα μόριο, ονομάζουμε τη σύνδεση μεταξύ κάθε ατόμου χημικό δεσμό . Ο δεσμός «κρατά μαζί» τα άτομα στο μόριο, το ιόν ή τον κρύσταλλο. Οι δεσμοί μπορεί συχνά να διαρκέσουν επ' αόριστον, μέχρι να διαλυθούν από μια εξωτερική δύναμη ή ενέργεια.
Ο χημικός δεσμός είναι η έλξη μεταξύ δύο ή περισσότερων ατόμων που τους επιτρέπει να είναι σε θέση να σχηματίσουν μια σταθερή χημική ένωση. Η ειδική φύση ενός χημικού δεσμού μπορεί να ποικίλλει, αλλά οι πιο γνωστοί είναι οι ομοιοπολικοί και ιοντικοί δεσμοί. Με αυτούς τους δεσμούς, παρέχει επαρκή ενέργεια μεταξύ των ατόμων όταν κάποιος έχει λιγότερη. Είναι η δύναμη της έλξης που συγκρατεί τα άτομα, επιτρέποντας στα ηλεκτρόνια να σχηματίσουν έναν δεσμό μεταξύ τους.
Κύριοι και δευτερεύοντες δεσμοί
Ο χημικός δεσμός μπορεί να είναι ένας από δύο τύπους. πρωτογενή και δευτερογενή ομόλογα. Στον πρωτεύοντα δεσμό υπάρχουν ομοιοπολικοί, ιοντικοί και μεταλλικοί δεσμοί. Στους δευτερεύοντες δεσμούς, υπάρχουν δεσμοί υδρογόνου και Van der Waals. Αυτοί οι δεσμοί είναι ασθενέστεροι και μεγαλύτερης εμβέλειας από τους πρωτογενείς δεσμούς, επειδή δεν περιλαμβάνουν ιόντα ή κοινή χρήση ηλεκτρονίων.
Χημικός δεσμός Τύποι
Ποιοι είναι οι τύποι των δεσμών στη χημεία; Ας δούμε τρεις από τους πιο δημοφιλείς τύπους δεσμών – ομοιοπολικούς δεσμούς, ιοντικούς δεσμούς και μεταλλικούς δεσμούς.
Ομοιοπολικοί δεσμοί
Ένας ομοιοπολικός δεσμός, ή μοριακός δεσμός, είναι ένας χημικός δεσμός που σχηματίζεται μεταξύ δύο ατόμων που μοιράζονται ένα ζεύγος ηλεκτρονίων. τα στοιχεία που σχηματίζουν αυτούς τους δεσμούς είναι γενικά αμέταλλα. Μερικά παραδείγματα οξυγόνου, υδρογόνου και αζώτου σε ενώσεις όπως το O2 και H2 Ο). Ένα καθοριστικό χαρακτηριστικό ενός ομοιοπολικού δεσμού είναι ότι η πυκνότητα ηλεκτρονίων είναι υψηλή στη μέση του δεσμού. Αυτό σημαίνει ότι τα ηλεκτρόνια είναι πιο πιθανό να βρεθούν ανάμεσα στα δύο άτομα παρά σε κάθε άκρο. Οι χημικοί μερικές φορές περιγράφουν και προβλέπουν τους τρόπους με τους οποίους σχηματίζονται οι ομοιοπολικοί δεσμοί χρησιμοποιώντας ένα μοντέλο που ονομάζεται μοριακή τροχιακή θεωρία.
Πολλαπλά ομόλογα
Οι ομοιοπολικοί δεσμοί μπορεί να είναι είτε απλοί είτε πολλαπλοί δεσμοί. Σε έναν μόνο δεσμό, μόνο ένα ζεύγος ηλεκτρονίων σθένους μοιράζεται μεταξύ δύο ατόμων. Ωστόσο, μερικές φορές τα άτομα μοιράζονται περισσότερα από ένα ζεύγη ηλεκτρονίων, σχηματίζοντας αυτό που ονομάζεται πολλαπλός δεσμός. Οι συνήθεις τύποι πολλαπλών δεσμών είναι διπλοί και τριπλοί, με δεσμούς υψηλότερης τάξης να σχηματίζονται μόνο σε ορισμένες εξωτικές ενώσεις μετάλλων μετάπτωσης. Τα στοιχεία που συμμετέχουν συχνότερα σε πολλαπλούς δεσμούς είναι:άνθρακας, άζωτο, οξυγόνο, φώσφορος και θείο.
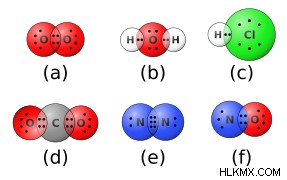
Πολικότητα δεσμού
Ένας ομοιοπολικός χημικός δεσμός μπορεί να είναι είτε πολικός είτε μη πολικός. Ένας πολικός ομοιοπολικός δεσμός μοιράζεται άνισα τα ηλεκτρόνια, πράγμα που σημαίνει ότι η κατανομή είναι ανισόρροπη και αφήνει ένα άτομο με μερικό αρνητικό φορτίο και το άλλο με μερικό θετικό φορτίο. Ένας μη πολικός ομοιοπολικός δεσμός μοιράζεται τα ηλεκτρόνια εξίσου στα δύο άτομα, με αποτέλεσμα μια ισορροπημένη κατανομή και μπορεί πραγματικά να σχηματιστεί μόνο μεταξύ δύο ατόμων του ίδιου στοιχείου. Ωστόσο, μερικές φορές οι χημικοί διακρίνουν μεταξύ «κυρίως» μη πολικών ομοιοπολικών δεσμών και πολικών ομοιοπολικών δεσμών, χρησιμοποιώντας τη διαφορά ηλεκτραρνητικότητας μεταξύ των ατόμων. Εάν η διαφορά ηλεκτραρνητικότητας είναι μικρότερη από περίπου 0,4 μονάδες, ένας δεσμός θεωρείται συνήθως μη πολικός. Εάν η διαφορά είναι μεγαλύτερη από 0,4, τότε ο δεσμός είναι πολικός με αυτό το πρότυπο. Με διαφορά μεγαλύτερη από 1,8 μονάδες, ο δεσμός δεν είναι πλέον καθόλου ομοιοπολικός, αλλά ιονικός (δείτε παρακάτω).
Ιωνικοί δεσμοί
Αυτός ο τύπος χημικού δεσμού περιλαμβάνει μεταφορά ηλεκτρονίων από το ένα άτομο στο άλλο, συνήθως από ένα μέταλλο σε ένα μη μέταλλο (Παραδείγματα περιλαμβάνουν NaCl και Li2 O).

- Μια ιοντική ένωση έχει πλήρη θετικά και αρνητικά φορτία αφού τα ηλεκτρόνια δεν μοιράζονται αλλά «κλέβονται» από το πιο ηλεκτραρνητικό άτομο.
- Το άτομο που χάνει ηλεκτρόνια έχει θετικό φορτίο, ενώ αυτό που αποκτά ηλεκτρόνια έχει αρνητικό φορτίο.
Μεταλλικοί δεσμοί
Οι μεταλλικοί δεσμοί είναι χημικοί δεσμοί μεταξύ των ατόμων ενός μετάλλου. Παρόμοια με μια θάλασσα ελεύθερα κινούμενων ηλεκτρονίων, αυτοί οι δεσμοί συνδέουν όλα τα άτομα του μετάλλου ταυτόχρονα (σε αντίθεση με τους ομοιοπολικούς δεσμούς, στους οποίους τα άτομα μοιράζονται διακριτά ζεύγη ηλεκτρονίων σε συγκεκριμένα μέρη ενός μορίου). Αυτοί οι χημικοί δεσμοί είναι υπεύθυνοι για πολλές ιδιότητες των χύδην μετάλλων, συμπεριλαμβανομένης της λάμψης και της ηλεκτρικής και θερμικής αγωγιμότητάς τους.
Χημικός δεσμός Θέματα σε άλλα άρθρα
- Ιωνικοί έναντι ομοιοπολικοί δεσμοί
- Τι είναι οι δεσμοί υδρογόνου
- Διαμοριακές δυνάμεις
- Επεξήγηση των δυνάμεων ιόντων-διπόλων
- Ενέργειες σχηματισμού δεσμών
Ο χημικός δεσμός και ο κανόνας της οκτάδας
Τα άτομα έχουν ηλεκτρόνια που ονομάζονται ηλεκτρόνια σθένους που βρίσκονται πιο μακριά από τον πυρήνα και συμμετέχουν σε χημικούς δεσμούς. Αυτά τα ηλεκτρόνια πρέπει να μοιραστούν ή να μεταφερθούν για να επιτευχθεί ο κανόνας της οκτάδας, ο οποίος δηλώνει ότι τα άτομα πρέπει να έχουν οκτώ ηλεκτρόνια στο εξωτερικό τους περίβλημα για να επιτευχθεί σταθερότητα. Ωστόσο, αυτός ο κανόνας ισχύει μόνο για τα κύρια στοιχεία της ομάδας, όπως ο άνθρακας και το άζωτο.
Το βόριο είναι μια αξιοσημείωτη εξαίρεση στον κανόνα της οκτάδας, καθώς συχνά προτιμά να έχει μόνο 6 ηλεκτρόνια, σχηματίζοντας ενώσεις όπως το BF3 ή το βορικό οξύ (H3BO3). Τα στοιχεία στην τρίτη σειρά του περιοδικού πίνακα και πέραν αυτής μπορεί να έχουν μια διευρυμένη οκτάδα, πράγμα που σημαίνει ότι έχουν περισσότερα από οκτώ ηλεκτρόνια στη στιβάδα σθένους τους. Ο φώσφορος, το θείο και το ιώδιο είναι κοινά στοιχεία που μπορεί να έχουν μια διογκωμένη οκτάδα.




