Τι είναι ο Τυφλοπόντικας και ο Αριθμός του Avogadro στη Χημεία
Βασικές έννοιες – Mole in Chemistry
Τι είναι λοιπόν ο τυφλοπόντικας; Σε αυτό το σεμινάριο, θα μάθετε τον ορισμό του mole, μιας σημαντικής μονάδας μέτρησης στη χημεία. Θα μάθετε επίσης για τον αριθμό του Avogadro και γιατί είναι χρήσιμος. Από εδώ, θα μπορείτε να χρησιμοποιήσετε αυτές τις έννοιες στην επίλυση προβλημάτων χημείας.
Θέματα που καλύπτονται σε άλλα άρθρα
- Ανάλυση διαστάσεων
- Μόρια έναντι ενώσεων
- Εξισορρόπηση μιας χημικής εξίσωσης
Ορισμός του Mole και του αριθμού του Avogadro
Το mole, ή "mol" είναι μια μονάδα μέτρησης στη χημεία, που χρησιμοποιείται για να προσδιορίσει έναν πολύ μεγάλο αριθμό μορίων, ατόμων ή σωματιδίων. Αυτός ο πολύ μεγάλος αριθμός ονομάζεται Avogadro’s Number:6,02214 x 10, ο αριθμός των μονάδων σε ένα mole. Αυτοί οι αριθμοί είναι πολύ σημαντικοί για να μας πουν για την ποσότητα των στοιχείων. Ένα mole μιας ουσίας θα καταλήξει να είναι οπουδήποτε από λίγα γραμμάρια ουσίας, έως εκατοντάδες γραμμάρια.
Εφαρμογές του Mole
Ένα mole ενός στοιχείου
Ας δούμε ένα μόριο ενός στοιχείου. Σε ένα μόνο mol, ανεξάρτητα από το στοιχείο, υπάρχουν 6,02214 x 10 άτομα. Αυτό σημαίνει ότι 1 mol υδρογόνου περιέχει 6,02214 x 10 άτομα υδρογόνου και 1 mol χλωρίου περιέχει 6,02214 x 10 άτομα χλωρίου. Ο τυφλοπόντικας έχει έναν τόνο εφαρμογών, σε όλα τα επίπεδα της χημείας, από εργαστηριακές εργασίες μέχρι εξισορρόπηση χημικών εξισώσεων. Ας το δούμε στην πράξη.
Ένα mol μιας ένωσης
Ας δούμε ένα mole μιας ένωσης, το χλωριούχο νάτριο - NaCl. Ένα mole NaCl θα έχει τον αριθμό των μορίων χλωριούχου νατρίου του Avogadro. Ένα mole χλωριούχου νατρίου περιέχει ένα mole ατόμων νατρίου και ένα mole ατόμων χλωρίου.
Το μόριο σε στοιχεία, μόρια και ενώσεις
Εάν ένα στοιχείο είναι γραμμένο με έναν συντελεστή, αυτός ο συντελεστής σας λέει τον αριθμό των γραμμομορίων αυτού του στοιχείου που υπάρχει. Για παράδειγμα, γράφοντας 2C, σημαίνει ότι υπάρχουν 2 mol άνθρακα. Με άλλα λόγια, υπάρχουν 2 mol ατόμων άνθρακα. Γνωρίζουμε ήδη ότι ένα mole ενός στοιχείου περιέχει 6,02214 x 10 άτομα (αριθμός Avogadro), επομένως δύο mole είναι ίδια με 2 * 6,02214 x 10 άτομα =12,04428 x 10 άτομα άνθρακα. Αυτή η ιδέα των συντελεστών θα εμφανιστεί πολύ στις χημικές εξισώσεις.
Εάν σε ένα δεδομένο μόριο ή ένωση, το στοιχείο έχει δείκτη, ο δείκτης σας λέει τα mol του στοιχείου σε ένα μόριο του μορίου. Σημειώστε τη λεπτή διάκριση μεταξύ γραμμομορίων ενός μορίου και γραμμομορίων ενός στοιχείου μέσα σε ένα μόριο. Ο αριθμός των γραμμομορίων ενός στοιχείου μπορεί να είναι διαφορετικός από τους γραμμομορίους αυτού του στοιχείου σε ένα μεγαλύτερο μόριο. Αυτό μπορεί να φαίνεται μπερδεμένο με την πρώτη ματιά, αλλά η εξέταση ορισμένων παραδειγμάτων θα σας βοηθήσει.
Παραδείγματα κατανόησης των τυφλοπόντικων στη χημεία
- Ανατρέξτε στο μόριο O2
- Δεδομένου ότι ο συντελεστής της ένωσης είναι 1, εργαζόμαστε με 1 mol του μορίου O2
- 1 mole O2 =6,02214 x 10 μόρια O2
- Δεδομένου ότι το άτομο Ο έχει δείκτη 2, αυτό σημαίνει ότι υπάρχουν δύο γραμμομόρια ατόμων Ο στο μόριο
- 2 moles O =2 * 6,02214 x 10 άτομα =12,04428 x 10 άτομα οξυγόνου
2. Ας δοκιμάσουμε την ανάλυση μιας ένωσης:CH4
- Δεδομένου ότι ο συντελεστής είναι 1, εργαζόμαστε με 1 mole της ένωσης CH4
- 1 mole CH4 =6,02214 x 10 μόρια CH4
- Μέσα στην ένωση υπάρχει 1 mole C, αφού ο δείκτης είναι 1
- 1 mole C =6,02214 x 10 άτομα C
- Μέσα στην ένωση υπάρχουν 4 mol H, αφού ο δείκτης είναι 4
- 4 moles H =4 * 6,02214 x 10 άτομα =24,08856 x 10 άτομα H
3. Εδώ είναι ένα ακόμη που προκαλεί πρόκληση:3NaCl
- Δεδομένου ότι ο συντελεστής της ένωσης είναι 3, δουλεύουμε με 3 mol της ένωσης NaCl
- 3 moles NaCl =3 * 6,02214 x 10 μόρια NaCl
- Μέσα στην ένωση υπάρχουν 3 mol Na (ο συντελεστής κατανέμεται και στα άτομα!)
- 3 moles NaCl =3 * 6,02214 x 10 =18,0663 x 10 άτομα Na
- Μέσα στην ένωση υπάρχουν 3 mol Cl
- 3 moles NaCl =3 * 6,02214 x 10 =18,0663 x 10 άτομα Cl
Μετατροπή από γραμμάρια σε κρεατοελιές
Είναι επίσης δυνατή η μετατροπή από γραμμάρια σε mole και αντίστροφα χρησιμοποιώντας το μοριακό βάρος ενός στοιχείου ή μιας ένωσης. Θυμηθείτε ότι το μοριακό βάρος μιας ένωσης είναι το άθροισμα του μοριακού βάρους των στοιχειωδών συστατικών της.
- Όταν δίνονται τα mol μιας ένωσης, για να βρείτε τα γραμμάρια, πολλαπλασιάστε κατά μοριακό βάρος.
- Όταν δίνονται τα γραμμάρια μιας ένωσης, για να βρείτε τους κρεατοελιές, διαιρέστε κατά μοριακό βάρος.
Για να βρείτε τα άτομα ενός μορίου με βάση τα γραμμάρια, είναι απαραίτητο πρώτα να μετατραπούν σε γραμμομόρια χρησιμοποιώντας μοριακό βάρος και μετά σε άτομα με τον αριθμό του Avogadro.
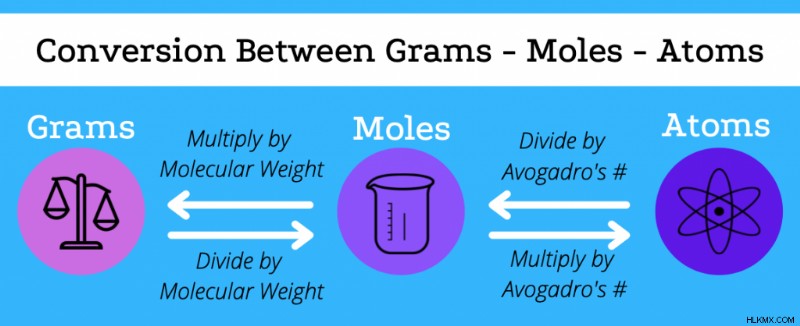
Παραδείγματα μετατροπών γραμμαρίων
- Πόσα γραμμάρια υπάρχουν σε 9,2 mole NO2 ?
- Το μοριακό βάρος του NO2 είναι 46 g/mol
- Για να βρείτε τα γραμμάρια σε 1,2 moles, διαιρέστε με το μοριακό βάρος!
- 9,2/46 =0,2 γραμμάρια ΟΧΙ2
2. Πόσα άτομα υπάρχουν σε 1,5 γραμμάριο CO;
- Πρώτα μετατρέψτε τα γραμμάρια CO σε mol χρησιμοποιώντας το μοριακό βάρος
- Το μοριακό βάρος του CO είναι 28 g/mol
- Moles CO =1,5 * 28 g/mol =42 moles
- Για να βρείτε τον αριθμό των ατόμων, πολλαπλασιάστε τον αριθμό των moles με τον αριθμό του Avogadro
- Άτομα CO =42 moles * 6,02214 x 10 =252,93 x 10 άτομα CO
Περαιτέρω ανάγνωση
Ευχαριστούμε που μάθατε τι είναι ο τυφλοπόντικας στη χημεία και για τον αριθμό του Avogadro. Για πιο γενικά θέματα χημείας, ανατρέξτε στα παρακάτω άρθρα!
- Διατομικά στοιχεία
- Τι είναι ένας χημικός δεσμός
- Επίλυση προβλημάτων στοιχειομετρίας
- Πώς να εξισορροπήσετε τις αντιδράσεις οξειδοαναγωγής




