Ο κανόνας του Hund
Τι είναι ο κανόνας του Hund;
Ο κανόνας της μέγιστης πολλαπλότητας του Hund, που συνήθως αναφέρεται ως ο κανόνας του Hund, δηλώνει ότι κάθε ατομικό τροχιακό σε ένα υποεπίπεδο καταλαμβάνεται μεμονωμένα πριν καταληφθεί διπλά και ότι όλα τα μεμονωμένα κατειλημμένα τροχιακά διαθέτουν ηλεκτρόνια με το ίδιο σπιν . Τα ηλεκτρόνια θα καταλαμβάνουν πάντα το δικό τους υποτροχιακό πριν ζευγαρώσουν με άλλο ηλεκτρόνιο στο ίδιο τροχιακό.
Αυτός ο κανόνας είναι χρήσιμος κατά την κατασκευή τόσο διαμορφώσεων ηλεκτρονίων όσο και μοριακών τροχιακών διαγραμμάτων.
Ο κανόνας του Χουντ σε δράση
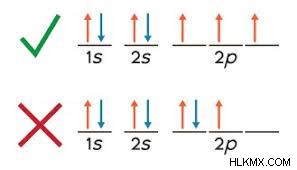
Σωστή χρήση
Το πιο συνηθισμένο λάθος που γίνεται όταν χρησιμοποιείται ο Κανόνας του Hund είναι η διπλή σύζευξη ηλεκτρονίων πριν αυτό είναι απαραίτητο. Κατά τη συμπλήρωση των τροχιακών p, τα ηλεκτρόνια δεν πρέπει να ζευγαρώνονται έως ότου κάθε υποτροχιακό έχει ένα ηλεκτρόνιο. Μόλις όλα τα τροχιακά έχουν ένα μόνο ηλεκτρόνιο, ζευγαρώστε τα με ηλεκτρόνια αντίθετου σπιν, ξεκινώντας πάλι από τα αριστερά. Όταν ληφθούν υπόψη όλα τα ηλεκτρόνια, η διαμόρφωση έχει ολοκληρωθεί!
Παράδειγμα διαμορφώσεων ηλεκτρονίων:Άζωτο
Ας δούμε ένα παράδειγμα του διαγράμματος ηλεκτρονίων πλαισίου για το άζωτο:
| Ν |  1 s 1 s |  2 δ. 2 δ. |    |
Το άζωτο έχει 7 ηλεκτρόνια και γνωρίζουμε ότι η διαμόρφωση ηλεκτρονίων του είναι 1s2 2s2 2p3. Το πλαίσιο 1s πρέπει να γεμίσει πριν από το 2s και το 2s πρέπει να γεμίσει πριν από το 2p. Αφού συμπληρώσουμε το 1 και το 2, χρησιμοποιήσαμε 4 από τα 7 διαθέσιμα ηλεκτρόνια μας, ενώ 3 απομένουν για το τροχιακό 2p.
Τώρα πρέπει να εφαρμόσουμε τον κανόνα του Hund! Τα ηλεκτρόνια θα καταλαμβάνουν πάντα το δικό τους υποτροχιακό πριν ζευγαρώσουν με ένα άλλο ηλεκτρόνιο στο ίδιο τροχιακό. Επομένως, κάθε ηλεκτρόνιο στο τροχιακό 2p αποκτά το δικό του κουτί και δεν υπάρχει ανάγκη για σύζευξη σπιν. Θα περιστρέφονται επίσης όλα προς την ίδια κατεύθυνση.
Παράδειγμα διαμόρφωσης ηλεκτρονίων:Οξυγόνο
Τώρα ας ρίξουμε μια ματιά στο διάγραμμα του κιβωτίου ηλεκτρονίων για το οξυγόνο. Η διαμόρφωση ηλεκτρονίων του οξυγόνου είναι 1s2 2s2 2p4.
Γνωρίζουμε ότι έχει 8 συνολικά ηλεκτρόνια και 6 στο εξωτερικό του περίβλημα. Όπως και με το άζωτο, τα τροχιακά 1s και 2s θα γεμίσουν, αλλά πρέπει να χρησιμοποιήσουμε τον κανόνα του Hund για να γεμίσουμε σωστά το τροχιακό 2p. Τα ηλεκτρόνια θα καταλαμβάνουν πάντα το δικό τους υποτροχιακό πριν ζευγαρώσουν με ένα άλλο ηλεκτρόνιο στο ίδιο τροχιακό. Επομένως, κάθε ηλεκτρόνιο στο τροχιακό 2p αποκτά το δικό του κουτί πριν ζευγαρώσουν οποιαδήποτε δύο ηλεκτρόνια. Ωστόσο, αυτή τη φορά έχουμε τέσσερα ηλεκτρόνια 2p και μόνο τρία κουτιά, οπότε αρχίζουμε να ζευγαρώνουμε από τα αριστερά, αφήνοντας τα δύο τελευταία τροχιακά με ένα ηλεκτρόνιο το καθένα.
| O |  1δ 1δ |  2 δ. 2 δ. |    |
Παράδειγμα διαμόρφωσης ηλεκτρονίων:Χλώριο
Τώρα θα δοκιμάσουμε τον κανόνα του Hund σε ένα στοιχείο με λίγα περισσότερα ηλεκτρόνια από το άζωτο ή το οξυγόνο.
| Cl |  1δ 1δ |  2 δ. 2 δ. |    2p 2p |  3 δ. 3 δ. |    |
Για άλλη μια φορά, βλέπουμε ότι τα πλαίσια έχουν συμπληρωθεί σύμφωνα με τον Κανόνα του Hund, όπου κάθε κιβώτιο ηλεκτρονίων σθένους λαμβάνει ένα ηλεκτρόνιο πριν από οποιοδήποτε πλαίσιο λάβει δύο. Όπως μπορείτε να δείτε, το χλώριο χρειάζεται μόνο ένα ακόμη ηλεκτρόνιο για να γεμίσει το κέλυφος n=3, καθιστώντας το εξαιρετικά αντιδραστικό. Θέλει να κλέψει μόνο ένα ακόμη ηλεκτρόνιο, το οποίο κάνει για παράδειγμα από νάτριο για να σχηματίσει επιτραπέζιο αλάτι.
Παράδειγμα διαμόρφωσης ηλεκτρονίων:Μαγγάνιο
Mn  1δ
1δ  2 δευτ.
2 δευτ.  2p
2p 

 3 δευτ.
3 δευτ.  4s
4s  3d
3d 




Ισχύει ο κανόνας του Hund, ακόμη και για πολλά μέταλλα μετάπτωσης, όπως το μαγγάνιο, για τα οποία πρέπει να έχουμε πρόσβαση στο τρισδιάστατο τροχιακό για να κατασκευάσουμε ένα κουτί διάγραμμα.
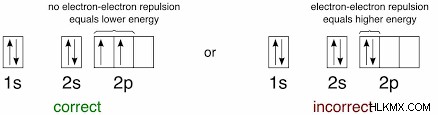
Σε άλλες ενώσεις μετάλλων μετάπτωσης, ένα φαινόμενο που ονομάζεται διάσπαση κρυσταλλικού πεδίου αναγκάζει τα τροχιακά d να έχουν διαφορετικές ενέργειες, παρόλο που βρίσκονται στο ίδιο υποκέλυφος! Αυτό συνήθως δεν συζητείται σε βάθος στο γενικό πρόγραμμα σπουδών χημείας, αλλά παίζει σημαντικό ρόλο σε ορισμένα μαθήματα φυσικής χημείας και ανόργανης χημείας. Σε αυτές τις περιπτώσεις, λόγω της χαμηλότερης ενέργειας ορισμένων από τα d τροχιακά, είναι στην πραγματικότητα πιο ευνοϊκό για αυτά να γεμίσουν πλήρως με ένα ζεύγος ηλεκτρονίων ενώ τα άλλα d τροχιακά δεν έχουν ακόμα ηλεκτρόνια. Το απλό σχηματικό παρακάτω δείχνει τη διαφορά στην ενέργεια Δ0 και το ασυνήθιστο μοτίβο πλήρωσης που προκύπτει.

Γιατί ισχύει ο κανόνας του Hund;
Όλα τα ηλεκτρόνια έχουν αρνητικό φορτίο και παρόμοια φορτία απωθούν το ένα το άλλο. Τα ηλεκτρόνια επιδιώκουν να ελαχιστοποιήσουν αυτήν την απώθηση, επομένως θα θέλουν πάντα να καταλαμβάνουν το τροχιακό τους όπου δεν υπάρχει άλλο ηλεκτρόνιο για να το απωθεί, αντί να μοιράζονται ένα τροχιακό με ένα άλλο ηλεκτρόνιο.
Ο λόγος για τον οποίο όλες οι μη ζευγαρωμένες περιστροφές πρέπει να ευθυγραμμίζονται προς την ίδια κατεύθυνση προέρχεται από τη φύση της περιστροφής. Οι περιστροφές αλληλεπιδρούν μεταξύ τους έτσι ώστε δύο παράλληλες περιστροφές να έχουν μικρότερη ενέργεια από δύο αντίθετες περιστροφές. Αυτό σημαίνει ότι εάν βάλετε δύο ηλεκτρόνια σε γειτονικά τροχιακά και προσανατολίσετε το ένα προς τα πάνω και το άλλο προς τα κάτω, αυτό θα είναι υψηλότερο σε ενέργεια, και επομένως όχι στη θεμελιώδη κατάσταση του ατόμου.
Ανακάλυψη του κανόνα
Ο Γερμανός φυσικός Friedrich Hund διατύπωσε αυτόν τον κανόνα το 1927. Εκείνη την εποχή, ο Hund ήταν λέκτορας στο Πανεπιστήμιο του Rostock. Περίπου αυτή την εποχή ανακάλυψε επίσης τα θεμέλια της Μοριακής Θεωρίας Τροχιακών και το φαινόμενο της κβαντικής σήραγγας.
Σημασία για την κατανόηση στοιχείων και υλικών
Κατά τις περισσότερες αντιδράσεις μεταξύ ατόμων, οι πρώτες αλληλεπιδράσεις συμβαίνουν μεταξύ των ηλεκτρονίων σθένους των δεδομένων ατόμων. Τα πιο σταθερά άτομα έχουν πλήρη κελύφη ηλεκτρονίων, όπως τα ευγενή αέρια. Σε ένα διάγραμμα κουτιού, θα έχουν κάθε κουτί διπλά γεμάτο. Τα πιο δραστικά άτομα έχουν ελλιπή κελύφη σθένους. Αυτά τα ασύζευκτα ηλεκτρόνια σθένους είναι που καθορίζουν τη χημεία και την αντιδραστικότητα του ατόμου. Ορισμένες ιδιότητες καθορίζονται επίσης από την πληρότητα του κελύφους ηλεκτρονίων σθένους, όπως το χρώμα του φωτός που εκπέμπεται από το στοιχείο όταν ένα ηλεκτρόνιο διεγείρεται σε υψηλότερο ενεργειακό επίπεδο και στη συνέχεια επιστρέφει στο κανονικό ενεργειακό του επίπεδο (βασική κατάσταση).
Μαγνητισμός
Μία από τις πιο σημαντικές συνέπειες της κυριαρχίας του Hund είναι η ύπαρξη μαγνητικών στοιχείων. Ονομάζουμε ένα στοιχείο με ασύζευκτα ηλεκτρόνια «παραμαγνητικό» επειδή το σπιν των μη συζευγμένων ηλεκτρονίων μπορεί να αλληλεπιδράσει και να ευθυγραμμιστεί με ένα μαγνητικό πεδίο. Στοιχεία με μόνο σύζευξη Τα ηλεκτρόνια, από την άλλη πλευρά, δεν έχουν καθαρό σπιν, επειδή όλα τα ηλεκτρόνια σπιν αλληλοεξουδετερώνονται. Αυτά τα στοιχεία δεν θα αλληλεπιδράσουν με ένα μαγνητικό πεδίο και ονομάζονται "διαμαγνητικά".
Αυτά τα παραδείγματα καθιστούν σαφές ότι ο κανόνας του Hund είναι ζωτικής σημασίας για την κατανόηση των χημικών και φυσικών ιδιοτήτων των στοιχείων!
Σχετικά σεμινάρια:
- Αρχή Aufbau
- Αρχή αποκλεισμού Pauli
- Εγγραφή διαμορφώσεων ηλεκτρονίων
- Τροχιακά ηλεκτρονίων
Σχέδια διαμόρφωσης ηλεκτρονίων από http://www.kentchemistry.com/links/AtomicStructure/PauliHundsRule.htm