Τι είναι η Μοραλικότητα; Ορισμός και τύπος
Βασικές έννοιες
Σε αυτό το σεμινάριο σχετικά με τη μοριακότητα, θα μάθετε τον ορισμό, τη σημασία και τον τρόπο υπολογισμού της μοριακότητας για την κατανόηση της συγκέντρωσης ενός διαλύματος. Παρέχονται παραδείγματα υπολογισμών.
Θέματα που καλύπτονται σε άλλα άρθρα
- Μοριακότητα
- Μείγματα
- Τι είναι ο τυφλοπόντικας;
- Ανάλυση διαστάσεων
- Στοιχειομετρία
Λεξιλόγιο
- Molality (m) :Μια μέτρηση της συγκέντρωσης χρησιμοποιώντας τον αριθμό γραμμομορίων διαλυμένης ουσίας ανά μάζα διαλύτη t
- Λύσεις :ομοιογενή μείγματα που αποτελούνται από διαλυμένη ουσία και διαλύτη
- Συλλογικές ιδιότητες: χαρακτηριστικά ενός διαλύματος που εξαρτώνται από τη συγκέντρωση ιόντων διαλυμένης ουσίας
- Μοριακότητα (Μ): Μια μέτρηση της συγκέντρωσης χρησιμοποιώντας τον αριθμό των γραμμομορίων διαλυμένης ουσίας ανά λίτρα διαλύματος
Βασικά στοιχεία λύσης
Τα διαλύματα είναι μείγματα με ομοιόμορφα αναμεμιγμένα ή ομοιογενή συστατικά. Επιπλέον, αυτά τα μείγματα μπορούν να κατασκευαστούν από οποιαδήποτε κατάσταση ύλης. Τα διαλύματα αποτελούνται από δύο συστατικά:τη διαλυμένη ουσία και τον διαλύτη. Η διαλυμένη ουσία είναι το δευτερεύον ή διαλυμένο μέρος του διαλύματος. Συγκριτικά, ο διαλύτης διαλύει τη διαλυμένη ουσία. Για παράδειγμα, στο διάλυμα του επιτραπέζιου σε νερό, το αλάτι είναι η διαλυμένη ουσία και το νερό είναι ο διαλύτης.
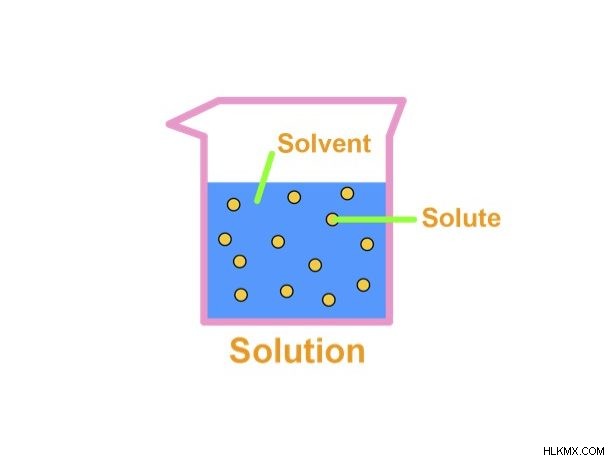
Τι είναι η μολικότητα;
Μοριακότητα, ή μοριακή συγκέντρωση, αναφέρεται στον αριθμό των γραμμομορίων διαλυμένης ουσίας διαιρεμένος με τη μάζα του διαλύτη , σε κιλά, mol∕kg. Αυτός ο όρος είναι χρήσιμος για την κατανόηση της συγκέντρωσης ενός διαλύματος επειδή ο τύπος του είναι ανεξάρτητος από τη θερμοκρασία και την πίεση. Έτσι, οι συλλογικές ιδιότητες εξαρτώνται από τη μοριακότητα. Οι συλλογικές ιδιότητες περιλαμβάνουν την ανύψωση του σημείου βρασμού, την πτώση του σημείου πήξης, τη μείωση της τάσης ατμών και την οσμωτική πίεση.
Υπολογισμός μοριακότητας
Τύπος:m =mol διαλυμένης ουσίας/ kg διαλύτη
Παράδειγμα:Ποια είναι η μοριακότητα ενός δείγματος 52 g επιτραπέζιου αλατιού (NaCl) σε ένα δείγμα 75 kg νερού;
Σε αυτό το παράδειγμα του προβλήματος, παρέχεται η μάζα της διαλυμένης ουσίας (επιτραπέζιο αλάτι) και η μάζα του διαλύτη (νερό). Χρησιμοποιώντας τις μονάδες του τύπου molality (mol/kg), προσδιορίστε εάν τα συστατικά του προβλήματος του παραδείγματος έχουν τις σωστές μονάδες. Σε αυτό το παράδειγμα, ο αριθμός των γραμμομορίων διαλυμένης ουσίας δεν παρέχεται, αλλά με τη γνωστή μάζα της διαλυμένης ουσίας, μπορεί να προσδιοριστεί ο αριθμός γραμμομορίων διαλυμένης ουσίας. Για να υπολογίσετε τον αριθμό των mol NaCl, χρησιμοποιήστε τη μοριακή μάζα του NaCl. Σε 1 mole NaCl, υπάρχουν 58,44 γραμμάρια NaCl. Με αυτή τη μοριακή μάζα NaCl γνωστή, η μετατροπή από γραμμάρια σε γραμμομόρια μπορεί να υπολογιστεί μέσω ανάλυσης διαστάσεων.
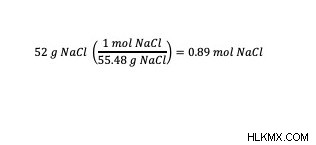
Κοιτάζοντας πίσω στον τύπο μοριακότητας, οι σωστές μονάδες είναι mol/kg. Η μάζα του διαλύτη με τις σωστές μονάδες παρέχεται στο πρόβλημα, επομένως δεν χρειάζεται ανάλυση διαστάσεων. Έτσι, διαιρέστε τον αριθμό των mol της διαλυμένης ουσίας με τη μάζα του διαλύτη για να υπολογίσετε τη μοριακότητα του διαλύματος.
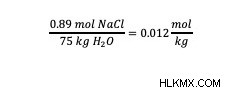
Μοριακότητα και Μοριακότητα
Ομοίως, η μοριακότητα είναι χρήσιμη για τον υπολογισμό της συγκέντρωσης ενός διαλύματος. Η μοριακότητα μετρά τον αριθμό των γραμμομορίων διαλυμένης ουσίας ανά όγκο διαλύματος , mol∕L, ή τον αριθμό γραμμομορίων ανά λίτρο διαλύματος. Επιπλέον, η μοριακότητα εξαρτάται από τη θερμοκρασία και επηρεάζεται από τις συλλογικές ιδιότητες.
| Molarity | Molality |
| Η αναλογία γραμμομορίων διαλυμένης ουσίας προς τον όγκο του διαλύματος σε λίτρα | Η αναλογία γραμμομορίων διαλυμένης ουσίας προς τη μάζα του διαλύτη σε χιλιόγραμμα |
| Αντιπροσωπεύεται από "M" | Αντιπροσωπεύεται από "m" |
| M =mole διαλυμένης ουσίας/ λίτρα διαλύματος | m =mole διαλυμένης ουσίας/κιλά διαλύτη |
| Εξαρτάται από τον όγκο ολόκληρης λύσης | Εξαρτάται μόνο από τη μάζα του διαλύτη |
| Εξαρτάται από την πίεση και τη θερμοκρασία | Ανεξάρτητα από αλλαγές στην πίεση και τη θερμοκρασία |
| Μονάδες:mol/L | Μονάδες:mol/kg |
Προβλήματα παραδείγματος μολικότητας
Τύπος:m =mol διαλυμένης ουσίας/kg διαλύτη
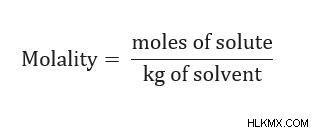
Θυμηθείτε να αναγνωρίσετε τις μονάδες (mol/kg)
- Υπολογίστε τη μοριακότητα ενός διαλύματος που αποτελείται από 35 g MgCl2 διαλυμένο σε 100 mL νερό. Η μοριακή μάζα του MgCl2 είναι 95,21 g/mol και η πυκνότητα του νερού είναι 1 g/mL.
- Υπολογίστε τη μοριακότητα ενός διαλύματος που αποτελείται από 20 g αιθανόλης διαλυμένης σε 300 mL ακετόνης. Η μοριακή μάζα της αιθανόλης είναι 46,07 g/mol και η πυκνότητα της ακετόνης είναι 0,790 g/mL.
- Υπολογίστε τον αριθμό των γραμμαρίων NaCl διαλυμένων σε 10 kg νερού. Η μοριακότητα του διαλύματος είναι 0,64 mol/kg και η μοριακή μάζα του NaCl είναι 55,48 g/mol.
Κλειδί απάντησης
- 3,7 mol/kg
- 1,8 mol/kg
- 355,1 g
Περαιτέρω αναγνώσεις:
- Διαλυτότητα
- Ksp, η σταθερά διαλυτότητας
- Κανόνες διαλυτότητας