Η αντίδραση Wittig
Βασικές έννοιες
Σε αυτό το σεμινάριο οργανικής χημείας, θα μάθετε τι είναι η αντίδραση Wittig και πώς συγκρίνεται με άλλες αντιδράσεις οργανικής χημείας που μπορεί να έχετε δει. Θα μάθετε επίσης για το αντιδραστήριο Wittig και τις χρήσεις του.
Ιστορικό:Ποιος είναι ο Georg Wittig;
Η αντίδραση Wittig είναι μια μακροχρόνια σημαντική αντίδραση στην οργανική χημεία, το μοναδικό πυρηνόφιλο και το ενδιάμεσό της επιτρέπουν προβλέψιμη και ειδική αντιδραστικότητα, η οποία είναι πάντα περιζήτητη στον τομέα της οργανικής χημείας. Georg Wittig, ένας Γερμανός χημικός, ανέπτυξε αυτή την αντίδραση. Κέρδισε το βραβείο Νόμπελ το 1981, στο πλευρό του Herbert C. Brown, για το έργο του με ενώσεις φωσφόρου. Άλλο αξιοσημείωτο έργο του Georg Wittig περιλαμβάνει τη σύνθεση του φαινυλιθίου και τις αναδιατάξεις 1,2-Wittg και 2,3-Wittig.
Τι είναι η αντίδραση Wittig;
Η αντίδραση Wittig δημιουργεί αλκένια, C=C δεσμούς, από κετόνες ή αλδεΰδες, C=O δεσμούς. Το γενικό σχήμα αντίδρασης είναι παρακάτω, όπου είτε μια κετόνη είτε μια αλδεΰδη αντιδρούν με ένα αντιδραστήριο Wittig (εξηγείται αργότερα στο άρθρο) για να παραχθεί ένας διπλός δεσμός άνθρακα άνθρακα.
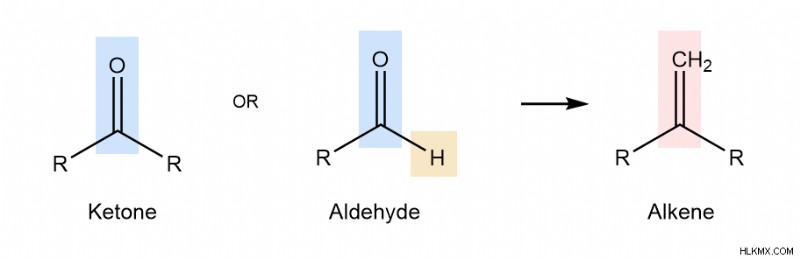
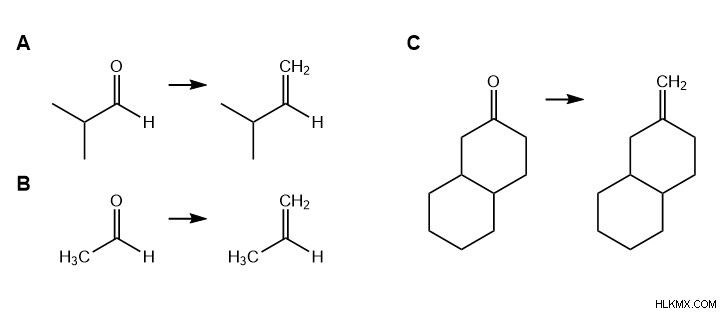
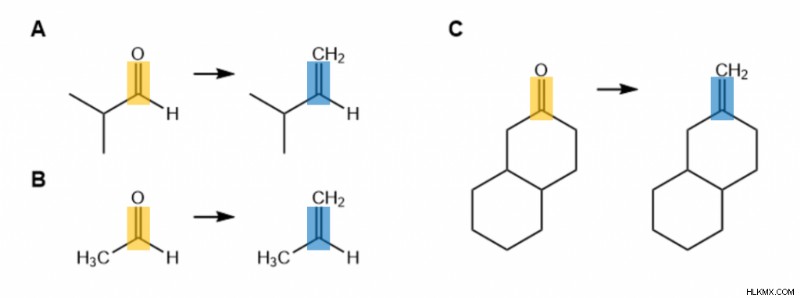
Αυτό το γενικό σχήμα μπορεί να εφαρμοστεί σε πιο συγκεκριμένες αντιδράσεις. Μερικά συγκεκριμένα παραδείγματα δίνονται παρακάτω. Προσπαθήστε να προσδιορίσετε την κετόνη/αλδεΰδη και το αλκένιο σε κάθε περίπτωση.
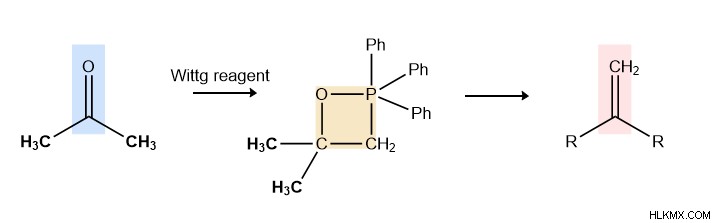
Τι είναι το αντιδραστήριο Wittig;
Η αντίδραση Wittig, όπως περιγράφηκε παραπάνω, καθίσταται δυνατή από ένα μοναδικό πυρηνόφιλο, το υλίδιο του φωσφονίου. Στην παρακάτω αντίδραση, το τριφαινυλοφωσφένιο (P(Ph)3) και το μεθυλοϊωδίδιο (Me-I) αντιδρούν για να δημιουργήσουν ένα υλίδιο φωσφονίου . Συγκεκριμένα, άλλα αλκυλαλογονίδια μπορούν να χρησιμοποιηθούν για την κατασκευή υλιδίων με διαφορετική δομή.

Λοιπόν, τι το ιδιαίτερο έχει ένα υλίδιο φωσφονίου; Για αρχή, έχει ένα θετικό φορτίο τοποθετημένο δίπλα σε ένα αρνητικό φορτίο. Αυτός είναι ο ορισμός του υλιδίου και επειδή το θετικό φορτίο βρίσκεται σε ένα άτομο φωσφόρου, το ονομάζουμε υλίδιο φωσφονίου. Αυτή η ιδιότητα του αντιδραστηρίου μας είναι σημαντική για τον μηχανισμό της αντίδρασης Wittg.
Δεύτερον, ο άνθρακας στο υλίδιο είναι αρνητικά φορτισμένος. Είναι σπάνιο να δεις ένα μοναχικό ζεύγος σε άνθρακα, καθώς δεν είναι συνήθως μια πολύ σταθερή διαμόρφωση. Αυτό επιτρέπει στον άνθρακα να δρα ως πυρηνόφιλο, όπως φαίνεται να κάνει στην αντίδραση Witting. Ο σχηματισμός δεσμών άνθρακα-άνθρακα είναι χαρακτηριστικό πολλών αξιοσημείωτων οργανικών αντιδράσεων, επειδή δεν είναι εύκολο κατόρθωμα.
Μηχανισμός
Ενδιάμεσο για την αντίδραση
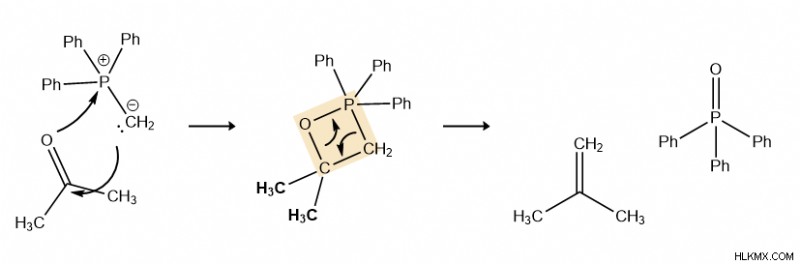
Η αντίδραση Witting μπορεί να αναπαρασταθεί σε δύο ή περισσότερα βήματα, αλλά η πιο σημαντική πτυχή του μηχανισμού είναι το ενδιάμεσο οξαφωσφατανίου, που εμφανίζεται με κίτρινο χρώμα.
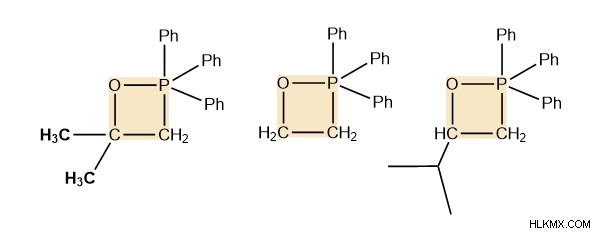
Οξαφωσφετάνιο
Τρία παραδείγματα οξαφωσφατανίου δίνονται παρακάτω, η γενική δομή είναι ο τετραμελής δακτύλιος σε πορτοκαλί χρώμα που αποτελείται από ένα οξυγόνο, δύο άτομα άνθρακα και P(Ph)3. Θα το δείτε ως ενδιάμεσο σε κάθε αντίδραση Wittg που συναντάτε.
Μηχανισμός
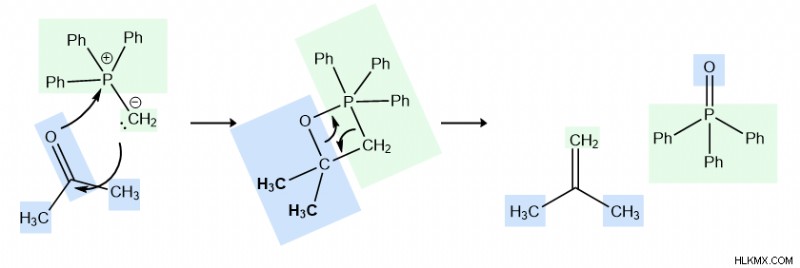
Η αντίδραση ξεκινά από τον πυρηνόφιλο άνθρακα (ο άνθρακας με το μοναχικό ζεύγος) συνδέοντας τον ηλεκτρόφιλο άνθρακα στο καρβονύλιο (προσκολλημένο στο οξυγόνο). Στη συνέχεια, ο διπλός δεσμός μεταξύ του καρβονυλικού οξυγόνου σπάει και τα επιπλέον ηλεκτρόνια από το καρβονυλικό οξυγόνο μεταφέρονται στον κεντρικό φώσφορο του υλιδίου του φωσφονίου. Αυτό αποτελεί το ενδιάμεσο.
Θραύσματα ομολόγων:C=O
Σχηματισμένοι δεσμοί:C-C, O-P
Στη συνέχεια, είναι ένα βήμα αποκυκλοποίησης. Οι δεσμοί C-O και P-C σπάνε στο ενδιάμεσο, και δημιουργούνται δύο νέοι διπλοί δεσμοί (P=O και C=C). Ο τετραμελής δακτύλιος στο ενδιάμεσο είναι σπασμένο και σχηματίζονται τα δύο προϊόντα που φαίνονται στα δεξιά. Η κινητήρια δύναμη για αυτήν την αντίδραση περιέχεται σε αυτό το τελευταίο βήμα:ο φώσφορος και το οξυγόνο σχηματίζουν έναν ισχυρό ομοιοπολικό δεσμό.
Σπασμένοι δεσμοί:C-O, P-C
Σχηματίστηκαν δεσμοί:P=O, C=C
Κλειδί απάντησης:
Κετόνη/Αλδεΰδες είναι σε πορτοκαλί. Αλκένια είναι μπλε.
Περαιτέρω ανάγνωση
- Αντιδραστήρια Grignard
- Αντιδράσεις Sn2 και Sn2
- Ηλεκτρόφιλο – Τι είναι;
- The Awesomeness of Element Phosphorus
- Αντιδράσεις συμπύκνωσης
- Αντίδραση Diels-Alder




