Δομικά Ισομερή
Βασικές έννοιες
Σε αυτό το σεμινάριο θα μάθετε πώς να ορίζετε δομικά ισομερή και πώς διαφέρουν από τα στερεοϊσομερή. Θα μάθετε επίσης πώς να κατηγοριοποιείτε διαφορετικούς τύπους δομικών ισομερών.
Θέματα που καλύπτονται σε άλλα άρθρα
- Λειτουργικές ομάδες
- Στερεοϊσομέρεια
- Διαστερεομερή και εναντιομερή
- Ονομασία αλκανίων
- Ταυτομερισμός DNA
Τι είναι ο Δομικός Ισομερισμός;
Ο δομικός ισομερισμός, που ονομάζεται επίσης ισομερισμός σύνθεσης, περιγράφει ένα σύνολο μορίων που είναι κατασκευασμένα με τα ίδια άτομα στις ίδιες ποσότητες, αλλά είναι διατεταγμένα διαφορετικά.
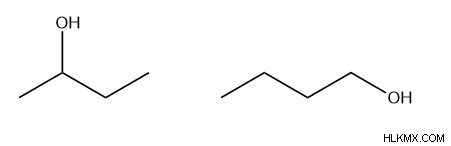
Η 2-βουτανόλη (αριστερά) και η 1-βουτανόλη (δεξιά) είναι δομικά ισομερή επειδή έχουν την ίδια ποσότητα και ποσότητα μορίων, αλλά διαφέρουν στη θέση της ομάδας αλκοόλης (-ΟΗ).
Δομική έναντι Στερεοϊσομέρειας
Τα δομικά ισομερή διαφέρουν συγκεκριμένα στις συνδέσεις μεταξύ των ατόμων και όχι στη διάταξη των ατόμων στο διάστημα, όπως στο παραπάνω παράδειγμα βουτανόλης, όπου η μόνη διαφορά μεταξύ των ατόμων είναι η θέση της αλκοόλης. Τα στερεοϊσομερή όπως τα cis trans ισομερή έχουν τους ίδιους δεσμούς μεταξύ των ίδιων ατόμων, αλλά διαφέρουν ως προς τη διαμόρφωση αυτών των δεσμών. Για παράδειγμα, το trans-2-βουτένιο και το cis-2-βουτένιο διαφέρουν ως προς τη διαμόρφωσή τους, αλλά οι δεσμοί μεταξύ των ατόμων δεν αλλάζουν από το ένα μόριο στο άλλο. Αυτό σημαίνει ότι ενώ φαίνονται διαφορετικά, είναι στερεοϊσομερή και όχι δομικά ισομερή.
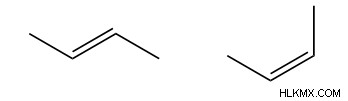
trans-2-βουτένιο cis-2-βουτένιο
Τύποι δομικών ισομερών
Τα δομικά ισομερή μπορούν να κατηγοριοποιηθούν περαιτέρω με βάση τις ειδικές δομικές τους διαφορές.
Θεσικός ισομερισμός
Ο ισομερισμός θέσης, που μερικές φορές ονομάζεται τοποϊσομερισμός, περιγράφει πότε τα μόρια διαφέρουν μόνο στην τοποθέτηση ενός ατόμου ή μιας ομάδας ατόμων, που δεν περιλαμβάνεται στη ραχοκοκαλιά αυτού του μορίου. Στο παράδειγμα που δίνεται για τη 2-βουτανόλη (αριστερά) και την 1-βουτανόλη (δεξιά), κινείται μόνο η ομάδα ΟΗ και επομένως θεωρείται ισομερές θέσης.

Λειτουργικός ισομερισμός
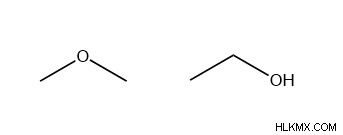
Ο λειτουργικός ισομερισμός περιγράφει πότε τα μόρια διαφέρουν στη λειτουργική ομάδα που υπάρχει. Αυτό είναι σημαντικό γιατί μόρια με την ίδια χημική σύνθεση, αλλά διαφορετικές λειτουργικές ομάδες μπορεί να έχουν δραστικά διαφορετική αντιδραστικότητα. Παρακάτω, ο διμεθυλαιθέρας (αριστερά) και η αιθανόλη έχουν και τα δύο τον χημικό τύπο C2 H6 Ο. Ο διμεθυλαιθέρας είναι ένας αιθέρας, που σημαίνει ότι είχε ένα οξυγόνο ανάμεσα σε δύο άνθρακες, και η αιθανόλη είναι μια αλκοόλη, που σημαίνει ότι έχει μια τερματική ομάδα -ΟΗ. Οι αιθέρες είναι γενικά λιγότερο αντιδραστικοί από τις αλκοόλες.
Ακολουθούν ορισμένα παραδείγματα λειτουργικών ομάδων.
Σκελετικός Ισομερισμός
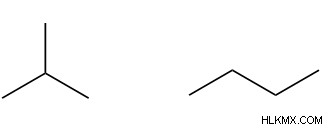
Ο σκελετικός ισομερισμός, που αναφέρεται επίσης ως ισομέρεια αλυσίδας, περιγράφει πότε τα μόρια διαφέρουν στη διάταξη της ραχοκοκαλιάς ή του σκελετού τους από άνθρακα. Στο παρακάτω παράδειγμα, το ισοβουτάνιο (αριστερά) και το βουτάνιο (δεξιά) είναι σκελετικά ισομερή, επειδή διαφέρουν ως προς τον τρόπο ταξινόμησης της ραχοκοκαλιάς τους από άνθρακα. Ενώ το βουτάνιο είναι γραμμικό, το ισοβουτάνιο δεν είναι, με τρεις από τους άνθρακές του να διακλαδίζονται από το κεντρικό άτομο άνθρακα.
Περαιτέρω ανάγνωση
- Υπολογισμός μοριακής μάζας
- Ονομασία ομοιοπολικών ενώσεων
- Μοριακή γεωμετρία και γωνίες δεσμών
- Δομές Lewis Dot
- Μόριο έναντι ένωσης




