Νόμος του Boyle – Ορισμός, Τύπος, Παράδειγμα

Νόμος του Μπόιλ ή νόμος της Μαριότ δηλώνει ότι η πίεση ενός ιδανικού αερίου είναι αντιστρόφως ανάλογη του όγκου υπό συνθήκες σταθερής μάζας και θερμοκρασίας. Όταν ο όγκος του αερίου αυξάνεται, η πίεση μειώνεται. Όταν ο όγκος μειώνεται, η πίεση αυξάνεται. Ο νόμος του Boyle πήρε το όνομά του από τον χημικό και φυσικό Robert Boyle, ο οποίος δημοσίευσε τον νόμο το 1862.
Ο νόμος του Boyle δηλώνει ότι η απόλυτη πίεση ενός ιδανικού αερίου είναι αντιστρόφως ανάλογη με τον όγκο του υπό συνθήκες σταθερής μάζας και θερμοκρασίας.

Τύπος του νόμου του Boyle
Υπάρχουν τρεις συνήθεις τύποι για το νόμο του Boyle:
P ∝ 1/V
PV =k
P1 V1 =P2 V2
Το P είναι απόλυτη πίεση, το V είναι όγκος και το k είναι σταθερά.
Διαγραφή του νόμου του Boyle
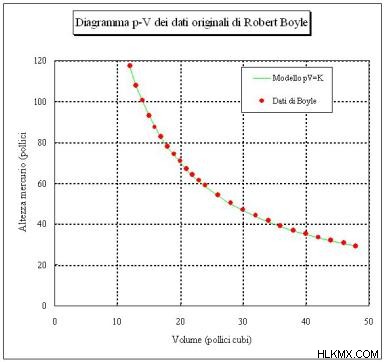
Το γράφημα του όγκου έναντι της πίεσης έχει ένα χαρακτηριστικό καμπυλωτό προς τα κάτω σχήμα που δείχνει την αντίστροφη σχέση μεταξύ πίεσης και όγκου. Ο Boyle χρησιμοποίησε το γράφημα των πειραματικών δεδομένων για να καθορίσει τη σχέση μεταξύ των δύο μεταβλητών.
Ιστορικό
Οι Richard Towneley και Henry Power περιέγραψαν τη σχέση μεταξύ της πίεσης και του όγκου ενός αερίου τον 17ο αιώνα. Ο Robert Boyle επιβεβαίωσε πειραματικά τα αποτελέσματά τους χρησιμοποιώντας μια συσκευή που κατασκεύασε ο βοηθός του, Robert Hooke. Η συσκευή αποτελούνταν από έναν κλειστό σωλήνα σχήματος J. Ο Μπόιλ έριξε υδράργυρο στον σωλήνα, μειώνοντας τον όγκο του αέρα και αυξάνοντας την πίεσή του. Χρησιμοποίησε διαφορετικές ποσότητες υδραργύρου, καταγράφοντας μετρήσεις πίεσης και όγκου αέρα και γραφικά τα δεδομένα. Ο Boyle δημοσίευσε τα αποτελέσματά του το 1662. Μερικές φορές ο νόμος των αερίων ονομάζεται νόμος Boyle-Mariotte ή νόμος της Mariotte επειδή ο Γάλλος φυσικός Edme Mariotte ανακάλυψε ανεξάρτητα το νόμο το 1670.
Παραδείγματα του νόμου του Boyle στην καθημερινή ζωή
Υπάρχουν παραδείγματα του νόμου του Boyle στην καθημερινή ζωή:
- Οι στροφές :Ένας δύτης ανεβαίνει αργά στην επιφάνεια του νερού για να αποφύγει τις στροφές. Καθώς ένας δύτης ανεβαίνει στην επιφάνεια, η πίεση από το νερό μειώνεται, γεγονός που αυξάνει τον όγκο των αερίων στο αίμα και τις αρθρώσεις. Η πολύ γρήγορη άνοδος επιτρέπει σε αυτά τα αέρια να σχηματίσουν φυσαλίδες, εμποδίζοντας τη ροή του αίματος και καταστρέφοντας τις αρθρώσεις, ακόμη και τα δόντια.
- Φυσαλίδες αέρα :Ομοίως, οι φυσαλίδες αέρα διαστέλλονται καθώς ανεβαίνουν σε μια στήλη νερού. Εάν έχετε ένα ψηλό ποτήρι, μπορείτε να παρακολουθήσετε τη φυσαλίδα να μεγαλώνει σε όγκο καθώς η πίεση μειώνεται. Μια θεωρία για το γιατί τα πλοία εξαφανίζονται στο Τρίγωνο των Βερμούδων σχετίζεται με τον νόμο του Μπόιλ. Τα αέρια που απελευθερώνονται από τον πυθμένα της θάλασσας ανεβαίνουν και διαστέλλονται τόσο πολύ που ουσιαστικά γίνονται μια γιγαντιαία φούσκα μέχρι να φτάσουν στην επιφάνεια. Μικρές βάρκες πέφτουν στις φυσαλίδες και καταποντίζονται από τη θάλασσα.
- Ψάρια βαθέων υδάτων :Τα ψάρια βαθέων υδάτων πεθαίνουν αν τα βγάλετε στην επιφάνεια. Καθώς η εξωτερική πίεση πέφτει, ο όγκος του αερίου στην κολυμβητική κύστη τους αυξάνεται. Ουσιαστικά τα ψάρια φουσκώνουν ή σκάνε.
- Σύριγγα :Πιέζοντας το έμβολο σε μια σφραγισμένη σύριγγα μειώνεται ο όγκος του αέρα στο εσωτερικό του και αυξάνεται η πίεσή του. Ομοίως, εάν έχετε μια σύριγγα που περιέχει μικρή ποσότητα νερού και τραβήξετε προς τα πίσω το έμβολο, ο όγκος του αέρα αυξάνεται, αλλά η πίεσή του μειώνεται. Η πτώση πίεσης είναι αρκετή για να βράσει το νερό μέσα στη σύριγγα σε θερμοκρασία δωματίου.
- Αναπνοή:Το διάφραγμα διευρύνει τον όγκο των πνευμόνων, προκαλώντας πτώση πίεσης που επιτρέπει στον εξωτερικό αέρα να εισχωρήσει στους πνεύμονες (εισπνοή). Η χαλάρωση του διαφράγματος μειώνει τον όγκο των πνευμόνων, αυξάνοντας την πίεση αερίου μέσα τους. Η εκπνοή γίνεται φυσικά για να εξισορροπηθεί η πίεση.
Πρόβλημα παραδείγματος νόμου του Boyle
Για παράδειγμα, υπολογίστε τον τελικό όγκο ενός μπαλονιού εάν έχει όγκο 2,0 L και πίεση 2 ατμόσφαιρες και η πίεση μειωθεί σε 1 ατμόσφαιρα. Ας υποθέσουμε ότι η θερμοκρασία παραμένει σταθερή.
P1 V1 =P2 V2
(2 atm)(2,0 L) =(1 atm)V2
V2 =(2 atm) (2,0 L)/(1 atm)
V2 =4,0 L
Είναι καλή ιδέα να ελέγξετε τη δουλειά σας για να βεβαιωθείτε ότι η απάντηση είναι λογική. Σε αυτό το παράδειγμα, η πίεση του μπαλονιού μειώθηκε κατά έναν παράγοντα δύο (μειώθηκε στο μισό). Η ένταση αυξήθηκε και διπλασιάστηκε. Αυτό είναι αυτό που περιμένετε από μια σχέση αντίστροφης αναλογίας.
Τις περισσότερες φορές, οι εργασίες για το σπίτι και τα τεστ απαιτούν συλλογισμό και όχι μαθηματικά. Για παράδειγμα, αν ο όγκος αυξηθεί κατά 10, τι συμβαίνει με την πίεση; Γνωρίζετε ότι η αύξηση του όγκου μειώνει την πίεση κατά το ίδιο ποσό. Η πίεση μειώνεται κατά 10.
Δείτε ένα άλλο πρόβλημα παραδείγματος του νόμου του Boyle.
Αναφορές
- Fullick, P. (1994). Φυσική . Heinemann. ISBN 978-0-435-57078-1.
- Holton, Gerald James (2001). Physics, The Human Adventure:From Copernicus to Einstein and Beyond . Rutgers University Press. ISBN 978-0-8135-2908-0.
- Tortora, Gerald J.; Dickinson, Bryan (2006). «Πνευμονικός αερισμός» στις Αρχές Ανατομίας και Φυσιολογίας (11η έκδ.). Hoboken:John Wiley &Sons, Inc. σελ. 863–867.
- Walsh, C.; Stride, Ε.; Cheema, U.; Ovenden, N. (2017). "Μια συνδυασμένη τρισδιάστατη in vitro-in silico προσέγγιση για τη μοντελοποίηση της δυναμικής των φυσαλίδων στη νόσο αποσυμπίεσης." Journal of the Royal Society Interface . 14(137). doi:10.1098/rsif.2017.0653
- Webster, Charles (1965). «Η ανακάλυψη του νόμου του Boyle και η έννοια της ελαστικότητας του αέρα τον δέκατο έβδομο αιώνα». Αρχείο για την Ιστορία των Ακριβών Επιστημών . 2(6) :441–502.