Οι Νόμοι της Θερμοδυναμικής
Βασικές έννοιες
Υπάρχουν τρεις θεμελιώδεις νόμοι της θερμοδυναμικής, οι οποίοι ασχολούνται με την κίνηση και τη μεταφορά ενέργειας. Ας μάθουμε γι' αυτά σε αυτόν τον οδηγό.
Τι είναι ένα σύστημα;
Πριν εμβαθύνουμε στους τρεις νόμους της θερμοδυναμικής, είναι σημαντικό να κατανοήσουμε την έννοια του συστήματος και του περιβάλλοντος χώρου.
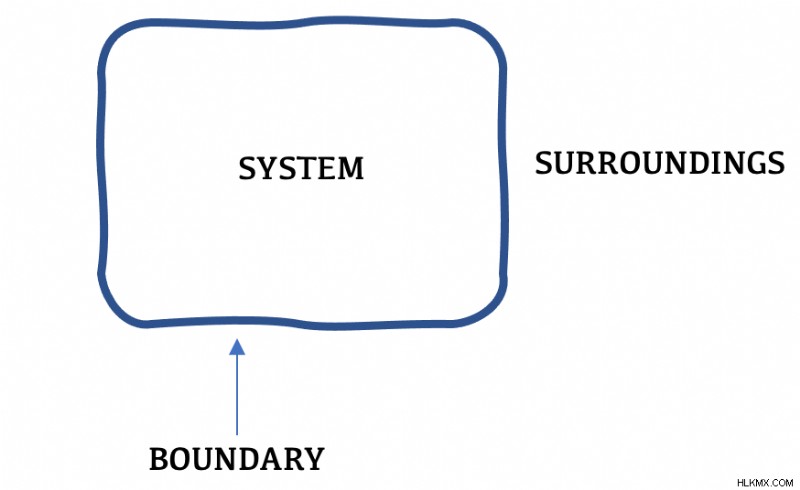
Η θερμοδυναμική γίνεται πολύ πιο εύκολη όταν χαράσσεται ένα σαφές όριο. Οτιδήποτε εντός του ορίου ονομάζεται «σύστημα» και οτιδήποτε έξω από το όριο ονομάζεται «περιβάλλον». Μόλις σχεδιαστεί το οριακό διάγραμμα, η κίνηση και η μεταφορά ενέργειας μπορεί να χαρακτηριστεί από τη ροή πέρα από τα όρια του συστήματος .
Ο όρος «σύμπαν» είναι ολόπλευρος. Με άλλα λόγια, αναφέρεται τόσο στο σύστημα όσο και στο περιβάλλον.
Τύποι συστημάτων
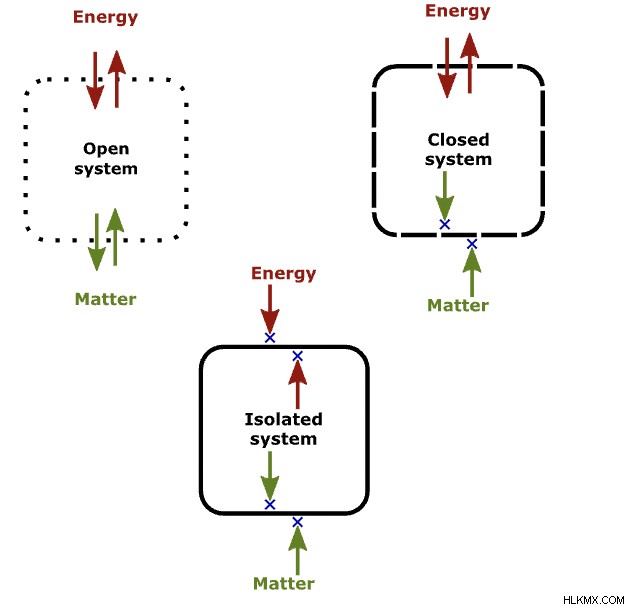
Με βάση τον τύπο του νόμου και των ανταλλαγών, υπάρχουν τρεις τύποι συστημάτων:ανοιχτά συστήματα, κλειστά συστήματα και απομονωμένα συστήματα. Πρώτον, σε ένα ανοιχτό σύστημα, υπάρχει μια ανταλλαγή τόσο ύλης όσο και ενέργειας. Στη συνέχεια, σε ένα κλειστό σύστημα, δεν υπάρχει ανταλλαγή ύλης αλλά κάποια ανταλλαγή ενέργειας. Τέλος, σε ένα ανοιχτό σύστημα, υπάρχει ανταλλαγή τόσο ύλης όσο και ενέργειας. Η κατανόηση των διαφορών μεταξύ αυτών των συστημάτων είναι ζωτικής σημασίας για την κατανόηση των νόμων της θερμοδυναμικής.
Τι είναι η θερμοδυναμική;
Η θερμοδυναμική είναι ο κλάδος της φυσικής που ασχολείται με τις σχέσεις μεταξύ εργασίας, θερμότητας, θερμοκρασίας και ενέργειας. Επιπλέον, η θερμοδυναμική εξετάζει την επιστήμη του πώς η θερμική ενέργεια μετατρέπεται μεταξύ των μορφών ενέργειας και πώς η θερμική ενέργεια επηρεάζει την ύλη. Ως θερμική ενέργεια ορίζεται η ενέργεια που προέρχεται από τη θερμότητα.
Νόμοι της Θερμοδυναμικής:Ο πρώτος
Ο πρώτος νόμος της θερμοδυναμικής συνοψίζεται ως εξής:η ενέργεια δεν μπορεί να δημιουργηθεί ή να καταστραφεί . Με άλλα λόγια, η συνολική ενέργεια του σύμπαντος πρέπει να παραμένει σταθερή, ή να διατηρείται.
∆Uσύμπαν =0
Ωστόσο, είναι σημαντικό να σημειωθεί ότι η ενέργεια παίρνει διαφορετικές μορφές. Ένας άλλος τρόπος επαναδιατύπωσης του πρώτου νόμου, είναι να πούμε ότι η μεταβολή της ενέργειας είναι ίση με τη ροή θερμότητας σε όλο το σύστημα (Q) συν το έργο που γίνεται στο σύστημα ή από το σύστημα (W).
∆Eσύστημα =Q + W
∂E = ∂ Q + ∂ W σε διαφορική μορφή
Έτσι, η θερμότητα και η εργασία είναι δύο διαδικασίες που μπορούν να αλλάξουν την εσωτερική ενέργεια ενός συστήματος. Εάν η θερμότητα ρέει στο σύστημα, το Q είναι θετικό. Αυτό σημαίνει ότι η θερμότητα κερδίζεται από το σύστημα και το ίδιο μέγεθος θερμότητας χάνεται από το περιβάλλον (ενδόθερμη αντίδραση). Εάν η θερμότητα ρέει έξω από το σύστημα, το Q είναι αρνητικό. Αυτό σημαίνει ότι η θερμότητα που χάνεται από το σύστημα είναι ίση σε μέγεθος με τη θερμότητα που λαμβάνεται από το περιβάλλον (εξώθερμη αντίδραση).
Η ίδια ιδέα είναι και για τη δουλειά. Εάν το περιβάλλον λειτουργεί όντως στο σύστημα, τότε η δουλειά είναι θετική. Εάν το σύστημα λειτουργεί στο περιβάλλον του, τότε η εργασία είναι αρνητική. Είτε έτσι είτε αλλιώς, η συνολική ενέργεια παραμένει διατηρημένη. Αυτό συνοψίζεται παρακάτω:

Νόμοι της Θερμοδυναμικής:Ο δεύτερος
Ο Δεύτερος Νόμος της Θερμοδυναμικής ασχολείται με την εντροπία και, ως ένα βαθμό, περιορίζει τον πρώτο νόμο. Σύμφωνα με τον δεύτερο νόμο, η εντροπία μιας αυθόρμητης διαδικασίας πρέπει να αυξάνεται και η εντροπία του σύμπαντος, ως απομονωμένου συστήματος, πρέπει πάντα να αυξάνεται. Αυτό συμβαίνει επειδή, η επίτευξη μέγιστης εντροπίας σημαίνει ότι ένα σύστημα βρίσκεται σε ισορροπία. Όλα τα συστήματα προσπαθούν πάντα να φτάσουν σε ισορροπία και να αυξήσουν την ελεύθερη ενέργεια Gibbs τους.
∆Sσύμπαν> 0
Οι διεργασίες μπορούν να επιτρέψουν τη μείωση της εντροπίας ενός συστήματος, αλλά στην περίπτωση αυτή, η εντροπία του περιβάλλοντος θα αυξηθεί. Αυτό δεν παραβαίνει τον δεύτερο νόμο.
∆Sσύμπαν =∆Sσύστημα + ∆Sπεριβάλλον
Αυθόρμητες διεργασίες
Μια αυθόρμητη διαδικασία είναι αυτή που συμβαίνει χωρίς οποιαδήποτε εισαγωγή. Σύμφωνα με τον δεύτερο θερμοδυναμικό νόμο, σε μια αυθόρμητη διαδικασία, η εντροπία πρέπει να αυξάνεται. Μπορείτε να κατανοήσετε την εντροπία είτε ως επίτευξη ισορροπίας είτε ως αυξανόμενη διαταραχή ενός συστήματος.
Ένα παράδειγμα αυθόρμητης διαδικασίας είναι η θερμότητα που μετακινείται από ένα ζεστό σε ένα ψυχρό σώμα. Η θερμότητα θα μετακινηθεί φυσικά από το ζεστό στο κρύο χωρίς εξωτερική είσοδο, επειδή το συνολικό σύστημα προσπαθεί να φτάσει σε ομοιόμορφη θερμοκρασία.
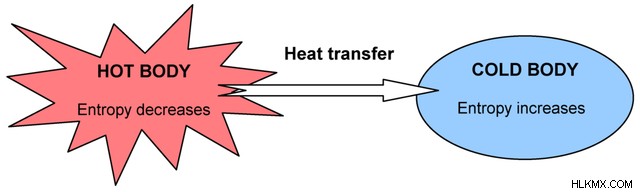
Καθώς η θερμότητα φεύγει από το σύστημα του θερμού συστήματος, η εντροπία της μειώνεται και στη συνέχεια καθώς εισέρχεται στο ψυχρό σύστημα, η εντροπία της αυξάνεται. Αυτή είναι μια αυθόρμητη διαδικασία.
Από την άλλη πλευρά, μια μη αυθόρμητη διαδικασία είναι αυτή όπου η εντροπία μειώνεται.
Σημειώστε ότι ο αυθορμητισμός δεν αναφέρεται σε ταχύτητα! Αναφέρεται σε μια διαδικασία που συμβαίνει φυσικά χωρίς παρεμβολές. Μια αυθόρμητη διαδικασία μπορεί πραγματικά να έχει πολύ αργό ρυθμό αντίδρασης.
Νόμοι της Θερμοδυναμικής:Ο Τρίτος
Ο Τρίτος Νόμος της Θερμοδυναμικής υποστηρίζει ότι η εντροπία ενός συστήματος πλησιάζει μια σταθερή τιμή καθώς η θερμοκρασία του πλησιάζει το απόλυτο μηδέν. Αυτός ο νόμος ισχύει γενικά για ένα καθαρό υλικό σε μια τέλεια κρυσταλλική δομή, επειδή η ελάχιστη ενέργειά του επιτρέπει την προσέγγιση της μηδενικής εντροπίας. Εάν ο κρύσταλλος δεν είναι τέλειος ή αν όχι στα 0 K, τότε θα υπάρξει θερμική κίνηση που θα οδηγήσει σε αταξία. Εκμάθηση

Περαιτέρω ανάγνωση
Η εξίσωση του νόμου του Hess
Ενθαλπία Ομολόγων &Ενέργεια Ομολόγων
Τα χημικά στοιχεία




