Διαφορά μεταξύ ιωδομετρίας και ιδιομετρίας
Κύρια διαφορά – Ιωδομετρία έναντι Ιωδομετρίας
Όπως υποδηλώνουν τα ονόματα Iodometry και Iodimetry, σχετίζονται με μια διαδικασία όπου εμπλέκεται το Iodine. Στην πραγματικότητα, και οι δύο αυτοί όροι αναφέρονται σε διαφορετικές μεθόδους χρήσης Ιωδίου σε τιτλοδοτήσεις για τον προσδιορισμό της συγκέντρωσης μιας υπό διερεύνηση αναλυόμενης ουσίας. Διαφέρουν στην προσέγγισή τους. Η ιωδομετρία είναι μια έμμεση μέθοδος τιτλοδότησης ενώ ηιωδιομετρία είναι μέθοδος άμεσης ογκομέτρησης. Αυτή είναι η κύρια διαφορά μεταξύ Ιωδομετρίας και Ιωδομετρίας.
Τι είναι η Ιωδομετρία
Όπως αναφέρθηκε παραπάνω, η ιωδομετρία είναι μια έμμεση μέθοδος. Σε αυτήν την περίπτωση, το Ιώδιο, το οποίο παρήχθη λόγω προηγούμενης αντίδρασης οξειδοαναγωγής, προσδιορίζεται ποσοτικά μέσω ξεχωριστής τιτλοδότησης και προσδιορίζεται η συγκέντρωση της αναλυόμενης ουσίας που παρήγαγε το Ιώδιο. Η τεχνική της Ιωδομετρίας χρησιμοποιείται συνήθως σε πειράματα όπου η ποσότητα των οξειδωτικών παραγόντων σε ένα υδάτινο σώμα πρέπει να ποσοτικοποιηθεί.
Αυτό που συμβαίνει εδώ είναι ότι μια περίσσεια ποσότητας διαλύματος ιωδιδίου (συνήθως ιωδιούχου καλίου) αναμιγνύεται με ένα δείγμα νερού που πρέπει να ελεγχθεί. Λόγω των οξειδωτικών παραγόντων που υπάρχουν στο υδάτινο σώμα, τα ιόντα ιωδίου οξειδώνονται σε ιώδιο, ενώ οι οξειδωτικοί παράγοντες μειώνονται. Αυτή είναι η αρχική αντίδραση οξειδοαναγωγής. Στη συνέχεια το παραγόμενο Ιώδιο τιτλοδοτείται με έναν αναγωγικό παράγοντα όπως διάλυμα θειοθειικού νατρίου. Εδώ, το ιώδιο ανάγεται σε ιόντα ιωδίου ενώ τα θειοθειικά ιόντα οξειδώνονται περαιτέρω. Αυτή είναι η δεύτερη αντίδραση οξειδοαναγωγής και είναι η αντίδραση που χρησιμοποιείται για την τιτλοδότηση. Αυτό εκτελείται παρουσία δείκτη αμύλου για να διευκολύνεται η αναγνώριση του τελικού σημείου. Το ιώδιο σχηματίζει ένα βαθύ μπλε σύμπλοκο χρώματος με το άμυλο και καθώς το ιώδιο διασπάται σε ιόντα ιωδίου, το χρώμα εξαφανίζεται.
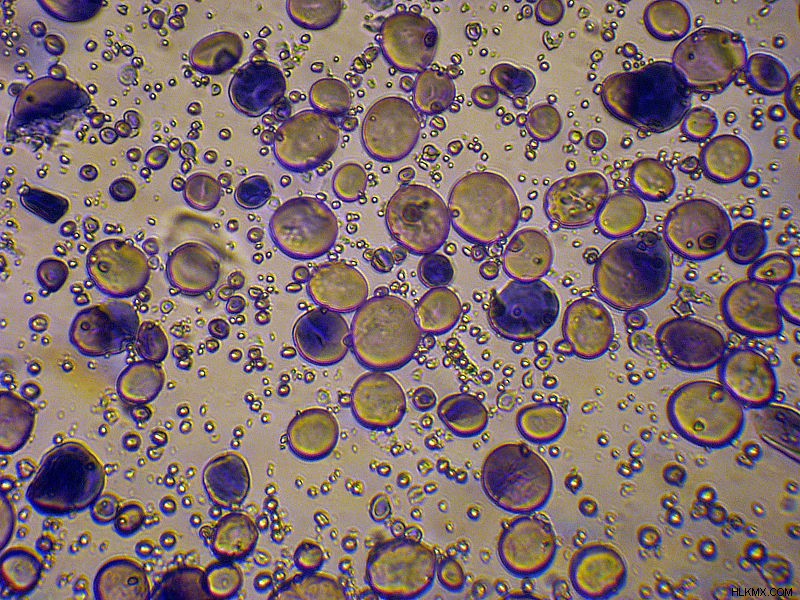
Κόκκοι αμύλου χρωματισμένοι με ιώδιο – μέσω μικροσκοπίου
Τι είναι η ιδιομετρία
Όπως αναφέρεται στον ορισμό, αυτή είναι μια μέθοδος άμεσης τιτλοδότησης. Η υπό διερεύνηση αναλυόμενη ουσία πρέπει να είναι ο αναγωγικός παράγοντας. Και αυτό τιτλοδοτείται απευθείας με ένα πρότυπο διάλυμα ιωδίου παρουσία κατάλληλου δείκτη. Επομένως, με τον προσδιορισμό του τελικού σημείου της αντίδρασης, μπορούν να προκύψουν εξισώσεις για τη λήψη πληροφοριών για τη στοιχειομετρία και άλλες απαραίτητες σχέσεις μεταξύ του αναγωγικού παράγοντα και του Ιωδίου που δρα ως οξειδωτικός παράγοντας σε αυτήν την περίπτωση.
Επομένως, σε αυτήν την περίπτωση, λαμβάνει χώρα μόνο μία αντίδραση οξειδοαναγωγής σε αντίθεση με την περίπτωση της ιωδομετρικής ογκομέτρησης. Ωστόσο, είναι πιο συνηθισμένο να χρησιμοποιούνται ιωδομετρικές μέθοδοι για ανάλυση παρά ιωδομετρικές μέθοδοι.

Διαφορά μεταξύ ιωδομετρίας και ιδιομετρίας
Ορισμός
Σε Iodometric Τιτλοδοτήσεις, το ιώδιο που έχει παραχθεί ως αποτέλεσμα προηγούμενης αντίδρασης οξειδοαναγωγής τιτλοδοτείται με έναν αναγωγικό παράγοντα όπως τα θειοθειικά ιόντα.
Στο Ιωδιομετρικό τιτλοδοτήσεις, ένα διάλυμα ιωδίου τιτλοδοτείται απευθείας με ένα αναγωγικό διάλυμα.
Διαδρομή τιτλοδότησης
Ένα ιωδομετρικό Η τιτλοδότηση είναι μια έμμεση μέθοδος ανάλυσης.
Ιωδιομετρία είναι μια μέθοδος άμεσης ανάλυσης.
Όχι. των αντιδράσεων οξειδοαναγωγής
Στην Ιωδομετρία, συμβαίνουν δύο αντιδράσεις οξειδοαναγωγής.
Στην Ιωδιομετρία , λαμβάνει χώρα μόνο μία διαδικασία αντίδρασης οξειδοαναγωγής.
Συμπεριφορά του ιωδίου
Στην Ιωδομετρία , Το ιώδιο οξειδώνεται πρώτα και μετά ανάγεται από έναν αναγωγικό παράγοντα.
Στην Ιωδιομετρία , το ιώδιο μειώνεται μόνο.
Χρήση
Ιωδομετρία εμφανίζεται πιο συχνά σε πειράματα.
Ιωδιομετρία είναι λιγότερο συχνή σε σύγκριση με την Ιωδομετρία.





