Γεγονότα ασβεστίου – Ατομικός αριθμός 20 και σύμβολο στοιχείου Ca
Το ασβέστιο είναι το 20 στοιχείο του περιοδικού πίνακα. Αυτά τα στοιχεία ασβεστίου περιέχουν χημικά και φυσικά δεδομένα μαζί με γενικές πληροφορίες και ιστορικό.

Κύτταρο περιοδικού πίνακα ασβεστίου
Βασικά στοιχεία για το ασβέστιο
Όνομα: Ασβέστιο
Ατομικός αριθμός: 20
Σύμβολο στοιχείου: Ca
Ομάδα: 2
Περίοδος: 4
Αποκλεισμός: s
Οικογένεια στοιχείων: Αλκαλική Γη
Ατομική μάζα: 40.078(4)
Διαμόρφωση ηλεκτρονίου: [Ar]4sFull:1s2s2p3s3p4s(full)
Ανακάλυψη: Ο Sir Humphry Davy το 1808
Ο Ντέιβι είναι γνωστός για τα πειράματά του στην ηλεκτρόλυση. Τοποθετούσε το όργανό του σε δείγματα διαφόρων κοινών χημικών ουσιών και παρατηρούσε τι συγκεντρώνεται στα ηλεκτρόδια. Απομόνωσε καθαρό ασβέστιο από μια πάστα ασβέστη (οξείδιο ασβεστίου) χρησιμοποιώντας ένα ηλεκτρόδιο υδραργύρου. Ένα στερεό αμάλγαμα ασβεστίου και υδραργύρου σχηματίστηκε όταν εφαρμόστηκε ρεύμα. Στη συνέχεια, ο Davy χρησιμοποίησε χημικές τεχνικές για να αφαιρέσει τον υδράργυρο και το στερεό ασβέστιο που παρέμεινε.
Προέλευση ονόματος: Το ασβέστιο πήρε το όνομά του από τη λατινική ονομασία του ασβέστη, calx .
Ισότοπα:
Το φυσικό ασβέστιο αποτελείται από έξι ισότοπα:Ca, Ca, Ca, Ca, Ca και Ca.
Υπάρχουν πέντε σταθερά και δεκαεννέα ραδιενεργά ισότοπα που κυμαίνονται από Ca έως Ca.
Ca
Το ασβέστιο-40 είναι ένα σταθερό ισότοπο που περιέχει 20 νετρόνια. Το 96,941% του φυσικού ασβεστίου είναι ασβέστιο-40. Το ασβέστιο-40 θεωρείται ότι είναι στην πραγματικότητα ένα ραδιενεργό ισότοπο με εξαιρετικά μεγάλο χρόνο ημιζωής (~ 10 χρόνια) με βάση την εσωτερική του δομή. Κανείς δεν έχει εντοπίσει ποτέ διάσπαση ενός ατόμου ασβεστίου-40.
Ca
Το ασβέστιο-42 είναι ένα σταθερό ισότοπο που περιέχει 22 νετρόνια. Το 0,647% του φυσικού ασβεστίου είναι ασβέστιο-42.
Ca
Το ασβέστιο-43 είναι ένα σταθερό ισότοπο που περιέχει 23 νετρόνια. Το 0,135% του φυσικού ασβεστίου είναι ασβέστιο-43.
Ca
Το ασβέστιο-44 είναι ένα σταθερό ισότοπο που περιέχει 24 νετρόνια. Το 2,086% του φυσικού ασβεστίου είναι ασβέστιο-44.
Ca
Το ασβέστιο-46 είναι ένα σταθερό ισότοπο που περιέχει 26 νετρόνια. Το 0,004% του φυσικού ασβεστίου είναι ασβέστιο-46.
Όπως και με το ασβέστιο-40, η εσωτερική δομή του ατόμου ασβεστίου-46 είναι θεωρητικά ασταθής και θα μπορούσε να είναι ραδιενεργή. Κανείς δεν έχει παρατηρήσει ποτέ τη διάσπαση ενός ατόμου ασβεστίου-46.
Ca
Το ασβέστιο-48 είναι σχεδόν ένα σταθερό ισότοπο που περιέχει 28 νετρόνια. Το ασβέστιο-48 έχει παρατηρηθεί ότι διασπάται σε τιτάνιο-48 με διπλή β- διάσπαση. Ο χρόνος ημιζωής αυτής της διάσπασης έχει υπολογιστεί σε 3.338 x 10 χρόνια. Αυτή η διάσπαση καθιστά το ασβέστιο-48 το ελαφρύτερο ισότοπο που υφίσταται διπλή β- διάσπαση. Το 0,187% του φυσικού ασβεστίου είναι ασβέστιο-48.

Μεταλλικό Ασβέστιο (Tomihahndorf)
Φυσικά δεδομένα
Πυκνότητα: 1,54 g/cm
Σημείο τήξης: 1115 K(842 °C, 1548 °F)
Σημείο βρασμού: 1757 K(1484 °C, 2703 °F)
Κατάσταση στους 20ºC: Στερεά
Heat of Fusion: 8,54 kJ/mol
Θερμότητα εξάτμισης: 154,7 kJ/mol
Μοριακή θερμική χωρητικότητα: 25,929 J/mol·K
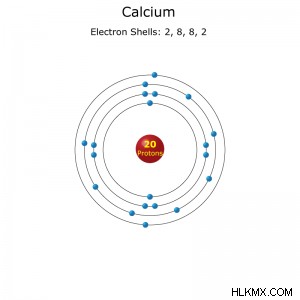
Διαμόρφωση κελύφους ηλεκτρονίων για ασβέστιο.
Ατομικά δεδομένα
Ατομική ακτίνα: 1,97 Å (εμπειρικό)
Ομοιοπολική ακτίνα: 1,76 Å
Ακτίνα Van der Waals: 2,31 Å
Συγγένεια ηλεκτρονίων: 2,369 kJ/mol
Ηλεκτραρνητικότητα: 1.00
1 Ενέργεια ιονισμού: 589,83 kJ/mol
2 Ενέργεια ιονισμού: 1145,447 kJ/mol
3 Ενέργεια ιονισμού: 4912,368 kJ/mol
4 Ενέργεια ιονισμού: 5876,92 kJ/mol
5 Ενέργεια ιονισμού: 8153 kJ/mol
6 Ενέργεια ιονισμού: 10495,68 kJ/mol
7 Ενέργεια ιονισμού: 12272,9 kJ/mol
8 Ενέργεια ιονισμού: 14206,5 kJ/mol
Κατάσταση οξείδωσης: +2 (κοινό), +1, -1 (ασυνήθιστο)

Δοκιμή φλόγας ασβεστίου. Credit:Herge/Creative Commons
Διασκεδαστικά στοιχεία για το ασβέστιο
- Το ασβέστιο είναι ένα μαλακό ασημί μέταλλο σε θερμοκρασία δωματίου. Αφήνοντας μόνο του, θα οξειδωθεί γρήγορα στον αέρα σχηματίζοντας μια θαμπή γκρίζα πατίνα.
- Το ασβέστιο καίγεται με μια φωτεινή πορτοκαλοκόκκινη φλόγα σε μια δοκιμή φλόγας.
- Το ασβέστιο χρησιμοποιείται στα πυροτεχνήματα για την προσθήκη πορτοκαλί χρώματος.
- Το ασβέστιο είναι το πέμπτο πιο άφθονο στοιχείο στο ανθρώπινο σώμα. Σχεδόν όλο το ασβέστιο στο σώμα σας βρίσκεται στα δόντια και τα οστά σας.
- Η βιταμίνη D είναι ζωτικής σημασίας για την απορρόφηση του ασβεστίου στο σώμα σας.
- Το ασβέστιο είναι το πέμπτο πιο άφθονο στοιχείο στον φλοιό της Γης, αντιπροσωπεύοντας περίπου το 4,1% κατά μάζα.
- Το ασβέστιο δεν βρίσκεται εγγενές στη φύση. Είναι πάντα μέρος μιας άλλης ένωσης.
- Τα κοχύλια των θαλάσσιων πλασμάτων είναι κυρίως ανθρακικό ασβέστιο.
- Το ασβέστιο μπορεί να βρεθεί σε αφθονία στον ασβεστόλιθο (ανθρακικό ασβέστιο), στον γύψο (θειικό ασβέστιο), στον φθορίτη (φθοριούχο ασβέστιο) και στον απατίτη (φωσφορικό ασβέστιο-χλωρό(ή φθορο-ασβέστιο).
- Το ασβέστιο παράγεται εμπορικά με θέρμανση ασβέστη (οξείδιο του ασβεστίου) με αλουμίνιο σε περιβάλλον χαμηλής πίεσης.
- Το ασβέστιο χρησιμοποιείται για την παραγωγή τσιμέντου, την παραγωγή τυριού, την αφαίρεση μη μεταλλικών ακαθαρσιών από κράματα και ως αναγωγικό παράγοντα για την παρασκευή άλλων μετάλλων.
- Το ασβέστιο ήταν γνωστό ότι υπήρχε για αιώνες πριν ο Davy το αναγνωρίσει ως στοιχείο.
Μάθετε περισσότερα σχετικά με τα στοιχεία στον περιοδικό πίνακα.




