4 Ιδιότητες Μεταλλοειδών
Τα μεταλλοειδή είναι στοιχεία που βρίσκονται μεταξύ των μετάλλων και των μη μετάλλων στον περιοδικό πίνακα των στοιχείων. Ονομάζονται επίσης ημιμέταλλα. Τα μεταλλοειδή έχουν ιδιότητες που είναι μεταξύ των ιδιοτήτων των μη μετάλλων και των μετάλλων. Τα περισσότερα μεταλλοειδή έχουν:
- Μια εμφάνιση παρόμοια με τα μέταλλα
- Είναι λιγότερο αγώγιμα από τα μέταλλα
- Είναι πιο εύθραυστα από τα μέταλλα
- Τα μεταλλοειδή έχουν γενικά μη μεταλλικές χημικές ιδιότητες
Άλλες ιδιότητες των μεταλλοειδών περιλαμβάνουν:ότι είναι καλοί ημιαγωγοί, τυπικά στερεοί υπό κανονικές συνθήκες, μπορούν να σχηματίσουν κράματα όταν συνδυάζονται με μέταλλα, συνήθως λειτουργούν σαν μη μέταλλα σε χημικές αντιδράσεις.
Ας ρίξουμε μια προσεκτική ματιά στα μεταλλοειδή και ας ανακαλύψουμε τι τα χωρίζει τόσο από μέταλλα όσο και από αμέταλλα.
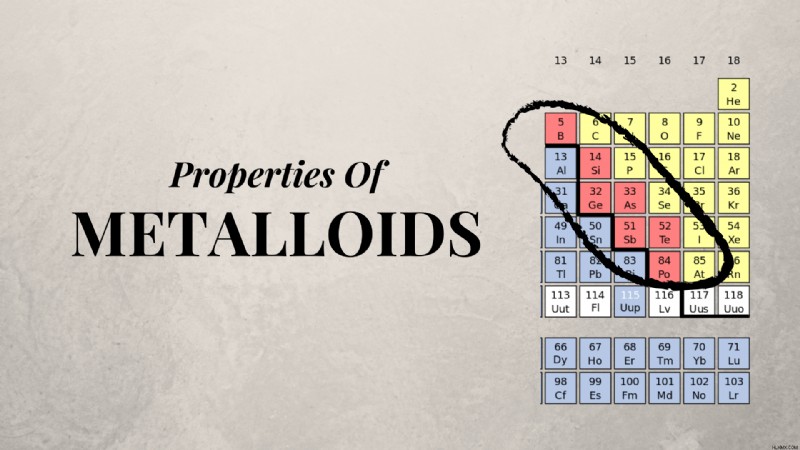
Τοποθεσία Μεταλλοειδών στον Περιοδικό Πίνακα
70 μέταλλα, ή μεταλλοειδή, βρίσκονται ανάμεσα σε αμέταλλα στον περιοδικό πίνακα των στοιχείων. Τα στοιχεία αυτού του εύρους έχουν ιδιότητες ενδιάμεσες μεταξύ των μη μετάλλων και των μετάλλων. Τα ακριβή στοιχεία που θεωρούνται μεταλλοειδή είναι κάπως προς συζήτηση, με διαφορετικά συστήματα ταξινόμησης που θεωρούν διαφορετικά στοιχεία μεταλλοειδή. Ωστόσο, τα ακόλουθα στοιχεία θεωρούνται γενικά μεταλλοειδή ή ημιμέταλλα:
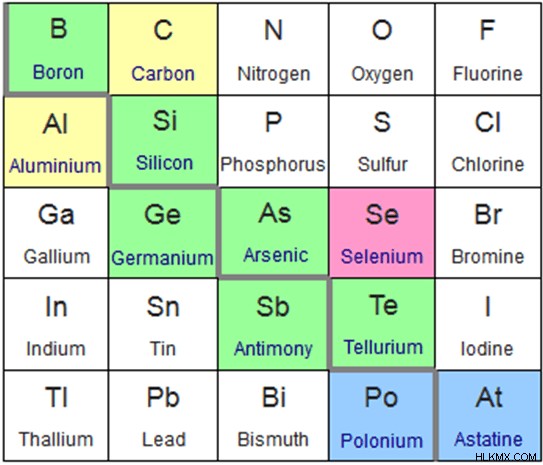
Αστατίνη, πολώνιο, τελλούριο, αντιμόνιο, αρσενικό, γερμάνιο, πυρίτιο, βόριο.
Το Tennessine ή το στοιχείο 117 δεν έχει αναλυθεί σε επαρκείς ποσότητες για να επαληθευτεί εάν είναι μεταλλοειδές ή όχι, αλλά οι επιστήμονες προβλέπουν ότι είναι ένα. Τα γειτονικά στοιχεία στον περιοδικό πίνακα μπορεί να έχουν μεταλλοειδή χαρακτηριστικά και ορισμένοι επιστήμονες μπορεί να τα κατηγοριοποιήσουν ως μεταλλοειδή. Ένα παράδειγμα είναι ο άνθρακας, ο οποίος ανάλογα με το αλλοτρόπιο μπορεί να ταξινομηθεί είτε ως μη μέταλλο είτε ως μεταλλοειδές. Όταν ο άνθρακας είναι σε μορφή διαμαντιού, συμπεριφέρεται παρόμοια με ένα μη μέταλλο, αλλά ο γραφίτης (άλλο αλλοτρόπο του άνθρακα) δρα ως ηλεκτρικός ημιαγωγός και έχει ακόμη και μεταλλική λάμψη, οπότε ορισμένοι τον θεωρούν μεταλλοειδές. Άλλα στοιχεία που έχουν αλλότροπα που μπορεί να είναι μεταλλοειδή ή μη μεταλλικά περιλαμβάνουν το οξυγόνο και τον φώσφορο. Στην περιβαλλοντική χημεία, το σελήνιο θεωρείται συχνά μεταλλοειδές. Άλλα στοιχεία που μπορούν να θεωρηθούν μεταλλοειδή όταν βρίσκονται υπό τις κατάλληλες συνθήκες είναι:μόλυβδος, γάλλιο, βισμούθιο, ψευδάργυρος, ραδόνιο, ιώδιο, θείο, άζωτο και υδρογόνο.
Οι ενέργειες ιονισμού και οι ηλεκτραρνητότητες των ημιμετάλλων/μεταλλοειδών βρίσκονται μεταξύ των μη μετάλλων και των μετάλλων, και ως εκ τούτου, τα μεταλλοειδή έχουν χαρακτηριστικά και για τις δύο αυτές κατηγορίες στοιχείων. Για παράδειγμα, αν και το πυρίτιο έχει χαρακτηριστική μεταλλική γυαλάδα, είναι αρκετά εύθραυστο και είναι αναποτελεσματικός αγωγός. Το στοιχείο με το οποίο αντιδρά ένα μεταλλοειδές επηρεάζει την αντιδραστικότητα του μεταλλοειδούς. Για παράδειγμα, όταν το βόριο αντιδρά με το φθόριο αντιδρά σαν μέταλλο, ωστόσο όταν το βόριο αντιδρά με το νάτριο αντιδρά σαν ένα μη μέταλλο. Οι πυκνότητες, τα σημεία βρασμού και τα σημεία τήξης των μεταλλοειδών ποικίλλουν ευρέως. Επειδή τα μεταλλοειδή έχουν ενδιάμεση αγωγιμότητα, συνήθως κάνουν καλούς ημιαγωγούς.
Κοινές ιδιότητες των μεταλλοειδών
Γενικά, τα μεταλλοειδή έχουν τις ακόλουθες κοινές ιδιότητες:
- Οι ηλεκτραρνητικότητες των μεταλλοειδών είναι μεταξύ αυτών των μη μετάλλων και των μετάλλων.
- Οι ενέργειες ιονισμού των μεταλλοειδών είναι επίσης μεταξύ αυτών των μη μετάλλων και των μετάλλων.
- Τα ημιμέταλλα/μεταλλοειδή έχουν ορισμένα χαρακτηριστικά των μη μετάλλων και ορισμένα χαρακτηριστικά των μετάλλων.
- Η αντιδραστικότητα των μεταλλοειδών εξαρτάται από τις ιδιότητες των στοιχείων με τα οποία αλληλεπιδρούν.
- Τα μεταλλοειδή τείνουν να είναι καλοί ημιαγωγοί.
- Τα μεταλλοειδή μπορεί να έχουν μεταλλική λάμψη, αλλά έχουν επίσης τα τροπάρια μας που μπορεί να έχουν μη μεταλλική εμφάνιση.
- Τα μεταλλοειδή είναι συνήθως εύθραυστα και είναι επίσης τυπικά στερεά, γίνονται μη στερεά μόνο υπό ασυνήθιστες συνθήκες.
- Τα μεταλλοειδή συνήθως συμπεριφέρονται ως μη μέταλλα στις χημικές αντιδράσεις και μπορούν να δημιουργήσουν κράματα με μέταλλα.
Συνοψίζοντας τις ιδιότητες των μεταλλοειδών

Συνοψίζοντας, ας ρίξουμε μια γρήγορη ματιά τόσο στις φυσικές ιδιότητες όσο και στις χημικές ιδιότητες των μεταλλοειδών. Οι φυσικές ιδιότητες είναι χαρακτηριστικά που μπορούν να τεκμηριωθούν ή να παρατηρηθούν χωρίς να αλλοιωθεί η ουσία του στοιχείου, χωρίς να μεταβληθεί η ομάδα των μορίων σε ουσίες. Οι φυσικές ιδιότητες περιλαμβάνουν πράγματα όπως το σημείο πήξης και η πυκνότητα. Οι φυσικές ιδιότητες των μεταλλοειδών είναι οι εξής:
- Τα μεταλλοειδή έχουν στερεή κατάσταση ύλης.
- Γενικά, τα μεταλλοειδή έχουν μεταλλική λάμψη. Τα μεταλλοειδή έχουν χαμηλή ελαστικότητα, είναι πολύ εύθραυστα.
- Τα μεσαία βάρη είναι ημιαγώγιμα στοιχεία και επιτρέπουν τη μέση μετάδοση θερμότητας.
Οι χημικές ιδιότητες είναι εκείνες που καθορίζουν τον τρόπο με τον οποίο μια ουσία αλληλεπιδρά/αντιδρά με άλλες ουσίες ή μετατρέπει μια ουσία σε άλλη ουσία. Οι χημικές αντιδράσεις είναι η μόνη φορά που οι χημικές ιδιότητες ενός στοιχείου μπορούν να ποσοτικοποιηθούν. Οι χημικές αντιδράσεις περιλαμβάνουν πράγματα όπως ορμή, κάψιμο, αμαύρωση, έκρηξη κ.λπ. Οι χημικές ιδιότητες των μεταλλοειδών είναι οι εξής:
- Τα μεταλλοειδή σχηματίζουν εύκολα αέρια όταν οξειδώνονται.
- Τα μεταλλοειδή μπορούν να συνδυαστούν με μέταλλα για να δημιουργήσουν κράματα.
- Τα μεταλλοειδή έχουν διαφορετικά μεταλλικά και μη μεταλλικά αλλότροπα.
- Όταν λιώνουν τα μεταλλοειδή, ορισμένα από αυτά θα συστέλλονται.
- Τα μεταλλοειδή μπορούν να αντιδράσουν με αλογόνα για να σχηματίσουν ενώσεις.
Στοιχεία για τα μεταλλοειδή
Το οξυγόνο είναι το πιο άφθονο στοιχείο στον φλοιό της Γης συνολικά, αλλά το πυρίτιο είναι το δεύτερο πιο άφθονο στοιχείο στον φλοιό. Τα μεταλλοειδή όπως το πολώνιο και το αρσενικό είναι πολύ τοξικά. Η βιομηχανία ηλεκτρονικών έχει μεγάλη χρήση για τα μεταλλοειδή, με μεταλλοειδή όπως το πυρίτιο που χρησιμοποιούνται για την κατασκευή τσιπ υπολογιστών. Το τελλούριο και το αντιμόνιο χρησιμοποιούνται για να δώσουν στα κράματα μετάλλων επιθυμητές ιδιότητες.
Δομή Μεταλλοειδών
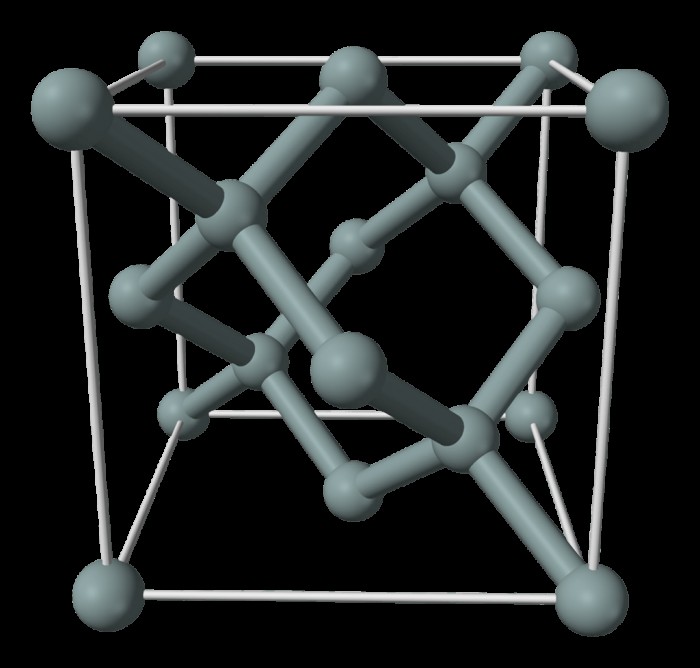
Τα μεταλλοειδή έχουν κρυσταλλική δομή που προκύπτει από ομοιοπολικούς δεσμούς. Το στοιχειώδες πυρίτιο, το αντιμόνιο, το αρσενικό, το γερμάνιο και το τελλούριο έχουν λαμπερή λάμψη και επομένως μοιάζουν με μέταλλα. Το γερμάνιο και το πυρίτιο έχουν δομή διαμαντιού όταν κρυσταλλώνονται. Τα άτομα μέσα στον κρύσταλλο έχουν ομοιοπολικούς δεσμούς που τα στερεώνουν σε τέσσερα γειτονικά άτομα στις γωνίες ενός τετραέδρου. Τα τεράστια τρισδιάστατα μόρια περιλαμβάνουν μονοκρυστάλλους γερμανίου και πυριτίου. Το αρσενικό έχει πολλά διαφορετικά αλλότροπα με το πιο σταθερό αλλοτρόπιο να έχει μια στρωματοποιημένη δομή που αποτελείται από φύλλα ατόμων αρσενικού. Τα άτομα αρσενικού συνδέονται με τρία άλλα άτομα γύρω τους. Το αντιμόνιο και το αρσενικό έχουν και τα δύο δομές που είναι παρόμοιες με τη δομή του γραφίτη, παρατεταγμένα σε πλέγμα. Εν τω μεταξύ, το τελλούριο έχει κρυστάλλους μέσα του που περιέχουν άπειρες σπειροειδείς αλυσίδες ατόμων τελουρίου.
Το βόριο σχηματίζει ένα εικοσάεδρο με άτομα βορίου σε κάθε γωνία και η κρυσταλλική δομή είναι διαφανής. Η πιο κοινή διάταξη των ατόμων είναι αυτή όπου είναι εξαιρετικά κοντά μεταξύ τους, με τους δεσμούς βορίου-βορίου να έχουν μήκος περίπου 176 PM. Υπάρχουν και άλλες μορφές των εικοσάεδρων, οι οποίες έχουν διαφορετική διάταξη των ατόμων βορίου.
Το μεταλλοειδές πυριτίου σχηματίζει εύκολα ενώσεις με οξυγόνο, δημιουργώντας δεσμούς σε μορφή si-o-si. Αυτοί οι δεσμοί είναι εξαιρετικά σημαντικοί για το σχηματισμό ορυκτών, κάπως ανάλογοι με τους δεσμούς άνθρακα που έχουν ύψιστη σημασία για το σχηματισμό οργανικών ενώσεων σε φυτά και ζώα.
Άλλοι τύποι στοιχείων
Εκτός από τα μεταλλοειδή, υπάρχουν επίσης μέταλλα και αμέταλλα. Τα μέταλλα βρίσκονται τόσο στη μέση όσο και στην αριστερή πλευρά του περιοδικού πίνακα των στοιχείων. Η ομάδα ΙΑ και η ομάδα ΙΙΑ είναι μέταλλα, και ένα άλλο σύνολο μετάλλων είναι τα μέταλλα μετάπτωσης - οι ομάδες IB έως VIIB στον περιοδικό πίνακα. Τα πρωτογενή μέταλλα βρίσκονται στα δεξιά των μετάλλων μετάπτωσης. Οι δύο κάτω σειρές στοιχείων είναι επίσης μέταλλα.
Τα μέταλλα είναι γνωστά ότι είναι πυκνά και γυαλιστερά και στερεά σε θερμοκρασία δωματίου, με εξαίρεση τον υδράργυρο που είναι υγρός σε θερμοκρασία δωματίου. Έχουν υψηλές πυκνότητες και υψηλά σημεία τήξης. Τα μέταλλα είναι επίσης γνωστά ότι έχουν χαμηλή ηλεκτραρνητικότητα, μεγάλη ατομική ακτίνα και χαμηλή ενέργεια ιονισμού. Αυτές οι ιδιότητες είναι τα αποτελέσματα των ηλεκτρονίων στο κέλυφος σθένους των ατόμων, τα οποία μπορούν εύκολα να αφαιρεθούν. Μια άλλη ιδιότητα των μετάλλων είναι το γεγονός ότι είναι ελατά, μπορούν εύκολα να παραμορφωθούν και να αναμορφωθούν χωρίς να σπάσουν. Τέλος, επειδή τα ηλεκτρόνια σθένους μπορούν να κινούνται μάλλον ελεύθερα στα μέταλλα, είναι καλοί αγωγοί τόσο της θερμότητας όσο και του ηλεκτρισμού.
Τα μη μέταλλα βρίσκονται στη δεξιά πλευρά του περιοδικού πίνακα και ενώ τόσο τα ευγενή αέρια όσο και τα αλογόνα είναι αμέταλλα, οι ομάδες μη μεταλλικών στοιχείων περιλαμβάνουν επίσης υδρογόνο, άνθρακα, οξυγόνο, άζωτο, φώσφορο, θείο και σελήνιο. Τα μη μέταλλα έχουν γενικά υψηλή ηλεκτραρνητικότητα, καθώς και υψηλές ενέργειες ιονισμού. Τα αμέταλλα δεν μεταδίδουν πολύ καλά ούτε ηλεκτρισμό ούτε θερμότητα. Τα στερεά αμέταλλα δεν έχουν καθόλου ή πολύ μικρή λάμψη και είναι συνήθως πολύ εύθραυστα. Τα μη μέταλλα μπορούν να αποκτήσουν ηλεκτρόνια εύκολα σε σύγκριση με άλλους τύπους στοιχείων.




