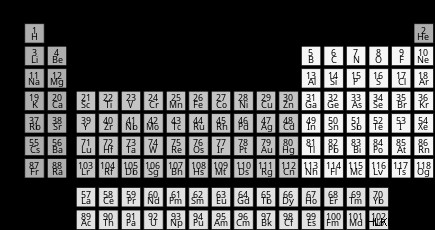
Στοιχεία Περιοδικού Πίνακα
Ο Dmitri Mendeleev, ένας Ρώσος χημικός που διατύπωσε τον περιοδικό νόμο ως σύνδεσμο μεταξύ χημικών ιδιοτήτων και ατομικής μάζας, σχεδίασε τον πρώτο καλά αναγνωρισμένο περιοδικό χάρτη το 1869. Επειδή δεν ήταν όλα τα στοιχεία γνωστά εκείνη την εποχή, ο Mendeleev Ο περιοδικός πίνακας περιλάμβανε κενά, αλλά ήταν σε θέση να προβλέψει τις ιδιότητες ορισμένων από τα στοιχεία που έλειπαν χρησιμοποιώντας τον περιοδικό νόμο. Ο περιοδικός νόμος αναγνωρίστηκε ως θεμελιώδης ανακάλυψη στα τέλη του δέκατου ένατου αιώνα, και εξηγήθηκε με την ανακάλυψη του ατομικού αριθμού και Η εργασία της κβαντικής μηχανικής των αρχών του εικοστού αιώνα που φώτισε την εσωτερική δομή του ατόμου. Η σύγχρονη χημεία δεν είναι πλέον πλήρης χωρίς τον περιοδικό πίνακα και τους νόμους του.
Επεξήγηση περιοδικού πίνακα
Είναι μια μέθοδος διάταξης γνωστών και παραγόμενων στοιχείων σε αύξουσα σειρά ατομικού αριθμού. Επίσης, έχει ρυθμιστεί με τέτοιο τρόπο ώστε τα στοιχεία με παρόμοια χαρακτηριστικά να ομαδοποιούνται μαζί. Με άλλα λόγια, μπορείτε να προσδιορίσετε ποια στοιχεία θα αντιδράσουν παρόμοια και ποια θα αντιδράσουν δραματικά διαφορετικά με μια ματιά. Για κάθε στοιχείο, ο περιοδικός πίνακας συνήθως παρέχει τα ακόλουθα πληροφορίες.Ο αριθμός των πρωτονίων που βρίσκονται στον πυρήνα ενός ατόμου είναι γνωστός ως ατομικός αριθμός. Το συνολικό βάρος των πρωτονίων, των νετρονίων και των ηλεκτρονίων σε ένα συγκεκριμένο άτομο είναι γνωστό ως ατομική μάζα.
Εάν το στοιχείο έχει ισότοπα, αυτό μπορεί να αλλάξει, επομένως η ατομική μάζα που αναφέρεται στον περιοδικό πίνακα είναι ο μέσος όρος αυτών των κυμαινόμενων βαρών. (Αυτές οι ατομικές μάζες με αγκύλες συνήθως υποδεικνύουν ότι ο αριθμός είναι κατά προσέγγιση. Αυτά τα στοιχεία με αγκύλες είναι είτε εξαιρετικά ασταθή είτε έχουν βρεθεί μόλις πρόσφατα.)
Το χημικό σύμβολο του στοιχείου, που είναι μια ονομασία ενός ή δύο γραμμάτων που χρησιμοποιούν οι επιστήμονες. Αυτός ο κώδικας χρησιμοποιείται σε όλο τον κόσμο για να σπάσει τα γλωσσικά εμπόδια όταν μιλάμε για χημικές ουσίες. Μερικά είναι προφανή, όπως το O για το οξυγόνο, ενώ άλλα, όπως το Pb για τον μόλυβδο, είναι λιγότερο. Αυτό οφείλεται στο γεγονός ότι το σύμβολο βασίζεται συνήθως στο λατινικό όνομα του στοιχείου, το οποίο στην περίπτωση του μολύβδου είναι plumbum. Όταν αναφέρεται σε ένα στοιχείο σε μια χημική ουσία ή μια εξίσωση, οι χημικοί χρησιμοποιούν το σύμβολό του, επομένως είναι σημαντικό να το γνωρίζουμε.
Ο ατομικός αριθμός και η ατομική μάζα του στοιχείου αυξάνονται καθώς μετακινείστε από αριστερά προς τα δεξιά στο τραπέζι. Καθώς μετακινείστε προς τα κάτω στον περιοδικό πίνακα, ισχύει το ίδιο.
Τάσεις περιοδικού πίνακα
Ατομική ακτίνα
Επειδή το πυρηνικό φορτίο αυξάνεται ενώ τα εξωτερικά ηλεκτρόνια παραμένουν στο ίδιο κέλυφος, οι ατομικές ακτίνες μειώνονται από αριστερά προς τα δεξιά κατά μήκος των στοιχείων της κύριας ομάδας. Οι ακτίνες συνήθως αυξάνονται καθώς ταξιδεύετε κάτω από μια στήλη, επειδή τα εξώτατα ηλεκτρόνια βρίσκονται σε υψηλότερα κελύφη και ως εκ τούτου πιο μακριά από τον πυρήνα.
Αν και ένα εσωτερικό κέλυφος γεμίζει τα μεταβατικά στοιχεία, το μέγεθος του ατόμου εξακολουθεί να υπαγορεύεται από τα εξωτερικά ηλεκτρόνια. Το υψηλότερο πυρηνικό φορτίο σε όλη τη σειρά, καθώς και ο αυξημένος αριθμός εσωτερικών ηλεκτρονίων για θωράκιση, αντισταθμίζουν εν μέρει το ένα το άλλο, με αποτέλεσμα μια μικρότερη μείωση της ακτίνας. Τα άτομα 4p και 5d είναι μικρότερα από το αναμενόμενο επειδή εμφανίζονται αμέσως μετά την εισαγωγή νέων ειδών μεταβατικών σειρών.
Ενέργεια ιονισμού
Η ενέργεια που απαιτείται για την αφαίρεση ενός ηλεκτρονίου από ένα άτομο είναι η πρώτη ενέργεια ιονισμού του. Η ενέργεια ιονισμού αυξάνεται από αριστερά προς τα δεξιά και από κάτω προς τα πάνω καθώς μειώνεται η ατομική ακτίνα, καθώς τα ηλεκτρόνια που βρίσκονται πιο κοντά στον πυρήνα συνδέονται με μεγαλύτερη ασφάλεια και επομένως πιο δύσκολο να απελευθερωθούν. Η ενέργεια ιοντισμού είναι επομένως η χαμηλότερη στο αρχικό στοιχείο κάθε περιόδου - υδρογόνο και αλκαλικά μέταλλα - και αυξάνεται σταθερά μέχρι να φτάσει στο ευγενές αέριο στη δεξιά άκρη της περιόδου. Υπάρχουν λίγες εξαιρέσεις σε αυτή την τάση, όπως το οξυγόνο, όπου το ηλεκτρόνιο που αφαιρείται είναι ζευγαρωμένο, γεγονός που καθιστά ευκολότερη την αφαίρεσή του από το αναμενόμενο λόγω της διαηλεκτρονικής απώθησης.
Συγγένεια ηλεκτρονίων
Η συγγένεια ηλεκτρονίων, η οποία είναι η ενέργεια που παράγεται όταν ένα ηλεκτρόνιο προστίθεται σε ένα άτομο, είναι το πολικό αντίθετο της ενέργειας ιονισμού. Ένα διερχόμενο ηλεκτρόνιο θα έλκεται πιο εύκολα σε ένα άτομο εάν αισθανθεί την έλξη του πυρήνα πιο έντονα, ειδικά εάν υπάρχει ένα μερικώς γεμάτο εξωτερικό τροχιακό έτοιμο να το φιλοξενήσει. Ως αποτέλεσμα, η συγγένεια ηλεκτρονίων τείνει να αυξάνεται από αριστερά προς τα δεξιά και από κάτω προς τα πάνω. Τα ευγενή αέρια, που έχουν πλήρες κέλυφος και δεν υπάρχει χώρος για άλλο ηλεκτρόνιο, αποτελούν την εξαίρεση στην τελευταία στήλη. Τα αλογόνα στην επόμενη προς την τελευταία στήλη έχουν τις υψηλότερες συγγένειες ηλεκτρονίων ως αποτέλεσμα αυτού. Τα ευγενή αέρια, για παράδειγμα, δεν έχουν συγγένεια ηλεκτρονίων και επομένως δεν μπορούν να σχηματίσουν σταθερά ανιόντα αέριας φάσης. Λόγω των μεγάλων ενεργειών ιονισμού τους και της έλλειψης συγγένειας ηλεκτρονίων, τα ευγενή αέρια έχουν μικρή τάση να απορροφούν ή να χάνουν ηλεκτρόνια και είναι γενικά μη αντιδραστικά. Το φθόριο, για παράδειγμα, είναι λιγότερο αντιδραστικό από το χλώριο, αλλά έχει χαμηλότερη συγγένεια ηλεκτρονίων.
Ηλεκτραρνητικότητα
Η ηλεκτροαρνητικότητα είναι ένα άλλο σημαντικό χαρακτηριστικό των στοιχείων. Τα άτομα μπορούν να δημιουργήσουν ομοιοπολικούς δεσμούς μοιράζοντας ηλεκτρόνια σε ζεύγη, με αποτέλεσμα μια τροχιακή επικάλυψη σθένους. Ο βαθμός στον οποίο κάθε άτομο αντλεί το κοινό ζεύγος ηλεκτρονίων καθορίζεται από την ηλεκτραρνητικότητα του ή την τάση του να αποκτά ή να χάνει ηλεκτρόνια. Το ζεύγος ηλεκτρονίων θα έλκεται προς το πιο ηλεκτραρνητικό (ή πιο ηλεκτροθετικό) άτομο, ενώ το λιγότερο ηλεκτραρνητικό (ή πιο ηλεκτροθετικό) άτομο θα έλκεται σε αυτό λιγότερο. Αν και αυτή είναι μια απλοποίηση, το ηλεκτρόνιο μπορεί να θεωρηθεί ότι έχει περάσει πλήρως από το πιο ηλεκτροθετικό άτομο στο πιο ηλεκτραρνητικό σε ακραίες περιπτώσεις. Η ηλεκτροαρνητικότητα καθορίζεται από το πόσο ισχυρά μπορεί ο πυρήνας να προσελκύσει ένα ζεύγος ηλεκτρονίων και ακολουθεί το ίδιο μοτίβο όπως και οι άλλες ιδιότητες που καλύφθηκαν μέχρι τώρα:η ηλεκτραρνητικότητα τείνει να μειώνεται καθώς κάποιος κινείται πάνω-κάτω και να αυξάνεται καθώς κινείται από αριστερά προς τα δεξιά. Τα πιο ηλεκτροθετικά στοιχεία είναι τα μέταλλα των αλκαλίων και των αλκαλικών γαιών, ενώ τα πιο ηλεκτραρνητικά στοιχεία είναι τα χαλκογόνα, τα αλογόνα και τα ευγενή αέρια.
Μεταλλικότητα
Τα πιο ηλεκτροθετικά άτομα, από την άλλη πλευρά, τείνουν να χάνουν ηλεκτρόνια, δημιουργώντας μια «ηλεκτρονική θάλασσα» που καταπίνει κατιόντα. Τα εξωτερικά τροχιακά ενός ατόμου επικαλύπτονται για να μοιράζονται ηλεκτρόνια με όλους τους γείτονές του, σχηματίζοντας μια τεράστια δομή μοριακών τροχιακών που εκτείνεται σε όλη τη δομή. Αυτή η αρνητικά φορτισμένη «θάλασσα» έλκει όλα τα ιόντα και τα συγκρατεί σε μια μεταλλική σύνδεση. Τα μέταλλα είναι στοιχεία που σχηματίζουν τέτοιους δεσμούς, ενώ τα αμέταλλα είναι στοιχεία που δεν σχηματίζουν τέτοιους δεσμούς. Τα αλλότροπα αναφέρονται στο γεγονός ότι ορισμένα στοιχεία μπορούν να συνδυαστούν για να δημιουργήσουν πολλές απλές ενώσεις με διακριτές δομές. Το διαμάντι και ο γραφίτης, για παράδειγμα, είναι δύο αλλότροπα του άνθρακα.
Συμπέρασμα
Με την πρόοδο της επιστήμης, ο περιοδικός πίνακας συνεχίζει να αλλάζει. Στη φύση υπάρχουν μόνο στοιχεία μέχρι τον ατομικό αριθμό 94. Για να προχωρήσουμε περαιτέρω, νέα στοιχεία πρέπει να συντεθούν στο εργαστήριο. Τα πρώτα 118 στοιχεία είναι πλέον γνωστά, συμπληρώνοντας τις πρώτες επτά σειρές του πίνακα, αλλά ο χημικός χαρακτηρισμός των βαρύτερων στοιχείων εξακολουθεί να απαιτείται για να διασφαλιστεί ότι οι ιδιότητές τους αντιστοιχούν στις τοποθεσίες τους. Δεν είναι σαφές πόσο μακριά θα εκτείνεται ο πίνακας πέρα από αυτές τις επτά σειρές ή εάν τα μοτίβα από το γνωστό τμήμα του πίνακα θα παραμείνουν σε αυτήν την αχαρτογράφητη περιοχή.