Διαφορά μεταξύ ισορροπίας και σταθερής κατάστασης
Κύρια διαφορά – Ισορροπία έναντι σταθερής κατάστασης
Η ισορροπία και η σταθερή κατάσταση είναι δύο όροι που χρησιμοποιούνται στη φυσική χημεία σχετικά με τις χημικές αντιδράσεις που λαμβάνουν χώρα σε ένα σύστημα. Συνήθως, σε μια χημική αντίδραση, τα αντιδρώντα μετατρέπονται σε προϊόντα. Σε ορισμένες αντιδράσεις, τα αντιδρώντα μετατρέπονται πλήρως σε προϊόντα, αλλά σε άλλες αντιδράσεις, τα αντιδρώντα μετατρέπονται εν μέρει σε προϊόντα. Και οι δύο αυτοί όροι περιγράφουν ένα στάδιο μιας συγκεκριμένης χημικής αντίδρασης όπου οι συγκεντρώσεις των συστατικών στο μείγμα αντίδρασης παραμένουν σταθερές. Αλλά η ισορροπία μιας αντίδρασης είναι διαφορετική από τη σταθερή κατάσταση για διάφορους λόγους. Η κύρια διαφορά μεταξύ ισορροπίας και σταθερής κατάστασης είναι ότι η ισορροπία είναι μια κατάσταση στην οποία ο ρυθμός της μπροστινής αντίδρασης ισούται με τον ρυθμό της προς τα πίσω αντίδρασης, ενώ η σταθερή κατάσταση είναι το στάδιο μιας χημικής αντίδρασης που έχει σταθερή συγκέντρωση ενός ενδιάμεσου .
Βασικές περιοχές που καλύπτονται
1. Τι είναι η Ισορροπία
– Ορισμός, Αρχή, Παράγοντες που επηρεάζουν την Ισορροπία
2. Τι είναι η Σταθερή Κατάσταση
– Ορισμός, Αρχή, Παράγοντες που επηρεάζουν τη Σταθερή Κατάσταση
3. Ποια είναι η διαφορά μεταξύ ισορροπίας και σταθερής κατάστασης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ισορροπία, Σταθερά Ισορροπίας, Αρχή του Le Châtelier, Προϊόντα, Αντιδρώντα, Ρυθμός Αντίδρασης, Σταθερή Κατάσταση 
Τι είναι η Ισορροπία
Η ισορροπία είναι μια κατάσταση στην οποία ο ρυθμός της προς τα εμπρός αντίδρασης ισούται με τον ρυθμό της προς τα πίσω αντίδρασης. Αν και ορισμένες χημικές αντιδράσεις ολοκληρώνονται, κάποιες άλλες αντιδράσεις δεν συμβαίνουν εντελώς. Για παράδειγμα, τα ασθενή οξέα και οι ασθενείς βάσεις σε υδατικά διαλύματα διασπώνται μερικώς σε ιόντα. Στη συνέχεια, μπορούμε να παρατηρήσουμε ότι υπάρχουν ιόντα καθώς και μόρια σε αυτό το διάλυμα. Έτσι, μπορεί να ειπωθεί ότι υπάρχει μια ισορροπία μεταξύ μορίων και ιόντων (π.χ.:οξύ και συζευγμένη βάση του). Αυτό συμβαίνει επειδή ο ρυθμός διάστασης του οξέος ή της βάσης είναι ίσος με τον ρυθμό σχηματισμού οξέος ή βάσης από τα ιόντα του.
Όταν ένα μείγμα αντίδρασης βρίσκεται σε ισορροπία, δεν υπάρχει καθαρή αλλαγή στις συγκεντρώσεις των αντιδρώντων και των προϊόντων. Ας εξετάσουμε ένα παράδειγμα για να κατανοήσουμε αυτήν την έννοια.

Εικόνα 1:Η ισορροπία μεταξύ του οξικού οξέος και της συζευγμένης βάσης του
Η παραπάνω εικόνα δείχνει την ισορροπία μεταξύ του οξικού οξέος και της συζευγμένης βάσης του. Εδώ, η προς τα εμπρός αντίδραση είναι η διάσταση του μορίου οξικού οξέος ενώ η αντίστροφη αντίδραση είναι ο σχηματισμός μορίων οξικού οξέος. Για να κατανοήσουμε τη συμπεριφορά ενός συστήματος ισορροπίας, μπορούμε να χρησιμοποιήσουμε την αρχή του Le Châtelier.
Σύμφωνα με την αρχή του Le Châtelier , όταν η ισορροπία ενός συστήματος διαταράσσεται, τείνει να αποκτήσει ξανά κατάσταση ισορροπίας αλλάζοντας κάποιες από τις συνθήκες του. Με άλλα λόγια, το σύστημα τείνει να επαναπροσαρμόζεται εάν διαταραχθεί η ισορροπία.
Για παράδειγμα, στην παραπάνω ισορροπία, αν προσθέσουμε περισσότερο οξικό οξύ στο διάλυμα, τότε η ποσότητα οξικού οξέος αυξάνεται σε αυτό το σύστημα. Στη συνέχεια, για να επιτευχθεί η ισορροπία, μερικά μόρια οξικού οξέος θα διαχωριστούν, σχηματίζοντας τη συζευγμένη βάση και το σύστημα θα αποκτήσει ξανά την ισορροπία. Με άλλα λόγια, η μπροστινή αντίδραση θα λάβει χώρα για να αναπροσαρμόσει το σύστημα.
Για συστήματα με ισορροπία, μπορούμε να ορίσουμε μια σταθερά ισορροπίας . Αυτή η σταθερά εξαρτάται από τις αλλαγές στη θερμοκρασία αυτού του συστήματος. Σε μια σταθερή θερμοκρασία, η σταθερά ισορροπίας έχει πάντα μια σταθερή τιμή για ένα συγκεκριμένο μείγμα αντίδρασης.
Τι είναι η Σταθερή Κατάσταση
Σταθερή κατάσταση μιας χημικής αντίδρασης είναι το στάδιο που έχει σταθερή συγκέντρωση ενός ενδιάμεσου. Εάν μια ορισμένη χημική αντίδραση λάβει χώρα μέσω πολλών σταδίων (στοιχειώδη στάδια), ο ρυθμός της αντίδρασης θα καθοριστεί από το βήμα προσδιορισμού της ταχύτητας. Είναι το πιο αργό βήμα μεταξύ άλλων. Στη συνέχεια δίνεται η ταχύτητα της αντίδρασης σχετικά με αυτό το πιο αργό βήμα. Αλλά όταν τα βήματα της αντίδρασης δεν είναι αναγνωρίσιμα, το πιο αργό βήμα δεν μπορεί να αναγνωριστεί για να προσδιοριστεί ο ρυθμός της αντίδρασης. Σε τέτοιες περιπτώσεις, μπορούμε να θεωρήσουμε το ενδιάμεσο προϊόν που έχει σταθερή συγκέντρωση για μικρό χρονικό διάστημα.
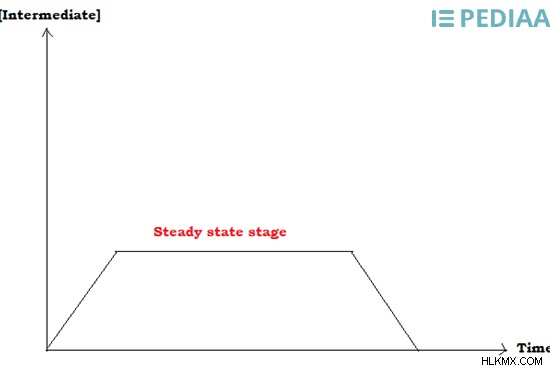
Τα στοιχειώδη βήματα της αντίδρασης σχηματίζουν ενδιάμεσα μόρια. Τα ενδιάμεσα είναι μόρια που δεν είναι ούτε αντιδρώντα ούτε προϊόντα αλλά είναι μόρια που σχηματίζονται κατά την εξέλιξη μιας χημικής αντίδρασης. Όταν το πιο αργό βήμα δεν είναι αναγνωρίσιμο, μπορούμε να χρησιμοποιήσουμε τη συγκέντρωση του ενδιάμεσου για τον υπολογισμό του ρυθμού της αντίδρασης. Αυτό το βραχύβιο ενδιάμεσο σχηματίζεται στη σταθερή κατάσταση της αντίδρασης.
Διαφορά μεταξύ ισορροπίας και σταθερής κατάστασης
Ορισμός
Ισορροπία: Η ισορροπία είναι μια κατάσταση στην οποία ο ρυθμός της προς τα εμπρός αντίδρασης ισούται με τον ρυθμό της προς τα πίσω αντίδρασης.
Σταθερή κατάσταση: Σταθερή κατάσταση μιας χημικής αντίδρασης είναι το στάδιο που έχει σταθερή συγκέντρωση ενός ενδιάμεσου.
Συγκεντρώσεις
Ισορροπία: Σε μια ισορροπία, οι συγκεντρώσεις των αντιδρώντων και των προϊόντων είναι σταθερές.
Σταθερή κατάσταση: Σε σταθερή κατάσταση, μόνο η συγκέντρωση του ενδιάμεσου προϊόντος είναι σταθερή.
Αντιδρώντα και προϊόντα
Ισορροπία: Σε κατάσταση ισορροπίας, η συγκέντρωση των αντιδρώντων και των προϊόντων είναι σταθερή.
Σταθερή κατάσταση: Σε σταθερή κατάσταση, η συγκέντρωση των αντιδρώντων και των προϊόντων αλλάζει.
Τύπος αντίδρασης
Ισορροπία: Οι ισορροπίες έχουν αντιδράσεις προς τα εμπρός και προς τα πίσω.
Σταθερή κατάσταση: Η σταθερή κατάσταση είναι χρήσιμη όταν το βήμα καθορισμού του ρυθμού δεν είναι αναγνωρίσιμο.
Συμπέρασμα
Οι όροι ισορροπία και σταθερή κατάσταση είναι χρήσιμοι για την πρόβλεψη του ρυθμού μιας χημικής αντίδρασης. Αν και οι εφαρμογές αυτών των όρων είναι διαφορετικές, τόσο η ισορροπία όσο και η σταθερή κατάσταση εξηγούν τη συμπεριφορά ενός μείγματος αντίδρασης. Η κύρια διαφορά μεταξύ ισορροπίας και σταθερής κατάστασης είναι ότι η ισορροπία είναι μια κατάσταση στην οποία ο ρυθμός της προς τα εμπρός αντίδρασης ισούται με τον ρυθμό της προς τα πίσω αντίδρασης, ενώ η σταθερή κατάσταση είναι το στάδιο μιας χημικής αντίδρασης που έχει σταθερή συγκέντρωση ενός ενδιάμεσου.




