Διαφορά μεταξύ σουλφόνωσης και θειοποίησης
Κύρια διαφορά – Σουλφόνωση έναντι Θειώσεως
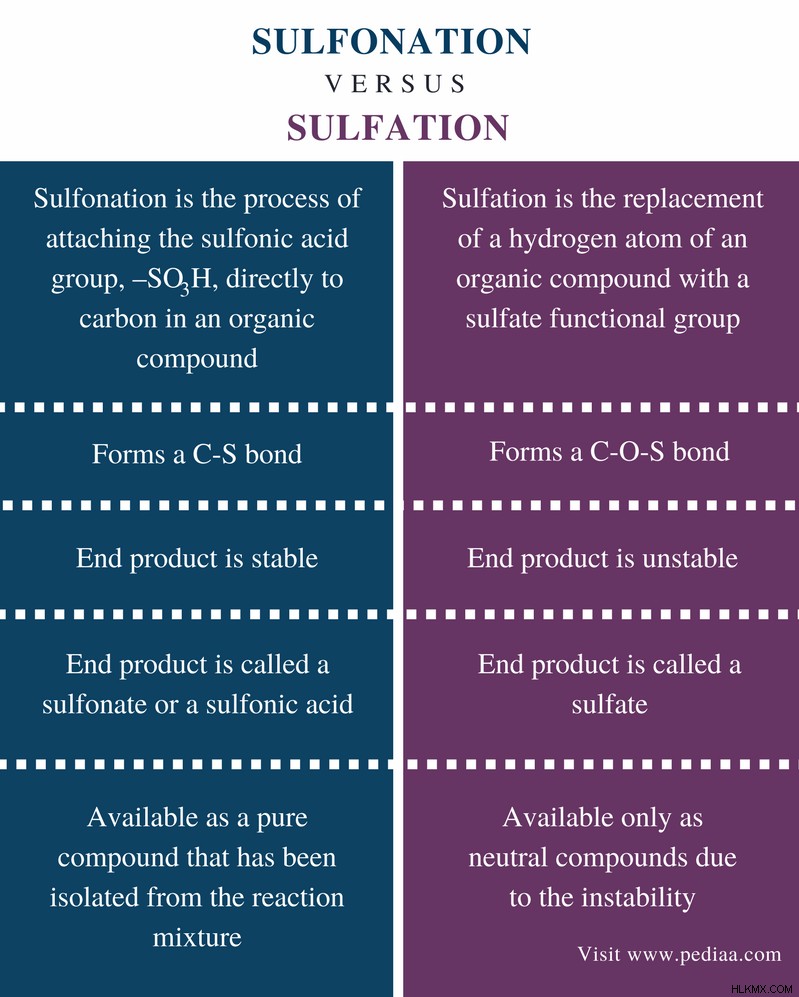
Η σουλφόνωση και η θείωση είναι δύο χημικές αντιδράσεις που προσθέτουν ή αντικαθιστούν ομάδες που περιέχουν θείο σε μόρια. Αυτές οι διεργασίες είναι σημαντικές βιομηχανικές χημικές διεργασίες που χρησιμοποιούνται για την παραγωγή μεγάλης ποικιλίας προϊόντων. Η σουλφόνωση είναι η διαδικασία παρασκευής οργανικών σουλφονικών οξέων. Σε αυτή τη διαδικασία, ενώσεις όπως το τριοξείδιο του θείου, το θειικό οξύ και το χλωροθειικό οξύ αντιδρούν με οργανικές ενώσεις. Η θείωση είναι επίσης μια σημαντική χημική διαδικασία που περιλαμβάνει το σχηματισμό ενός δεσμού C-O-S. Η κύρια διαφορά μεταξύ σουλφόνωσης και θειώσεως είναι ότι Η σουλφόνωση περιλαμβάνει το σχηματισμό ενός δεσμού C-S ενώ η θείωση περιλαμβάνει το σχηματισμό ενός δεσμού C-O-S.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η σουλφονίωση
– Ορισμός, Έλεγχος της αντίδρασης, Βιομηχανική Παραγωγή
2. Τι είναι η σουλφίωση
– Ορισμός, αντιδράσεις, τελικό προϊόν
3. Ποια είναι η διαφορά μεταξύ σουλφόνωσης και θειώσεως
– Σύγκριση βασικών διαφορών
Βασικοί όροι:χλωροθειικό οξύ, θειικό άλας, θείωση, σουλφονικό, σουλφονικό οξύ, σουλφονικό οξύ, θειικό οξύ, τριοξείδιο του θείου
Τι είναι η σουλφοποίηση
Η σουλφόνωση είναι η διαδικασία απευθείας σύνδεσης της ομάδας σουλφονικού οξέος, –SO3 Η, σε άνθρακα σε οργανική ένωση. Το τελικό προϊόν της διαδικασίας σουλφονίωσης ονομάζεταισουλφονικό . Η σουλφόνωση περιλαμβάνει μια οργανική ένωση που αντιδρά με μια όξινη ένωση που περιέχει θείο όπως το τριοξείδιο του θείου (SO3 ), θειικό οξύ (H2 SO4 ) ή χλωροθειικό οξύ.
Οι αντιδράσεις σουλφόνωσης σχηματίζουν έναν δεσμό C-S μεταξύ ενός από τα άτομα άνθρακα της οργανικής ένωσης και του ατόμου θείου της ένωσης που περιέχει θείο. Η τελική ένωση είναι μια όξινη ένωση και κατηγοριοποιείται ως σουλφονικό οξύ. Μετά την παραγωγή, τα σουλφονικά οξέα μπορούν να απομονωθούν και να αποθηκευτούν λόγω της σταθερότητάς τους.
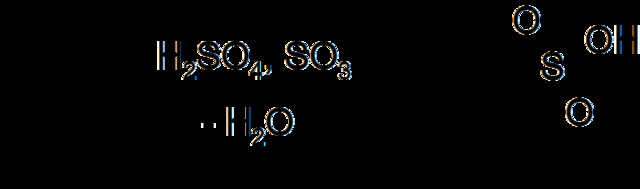
Εικόνα 1:Σουλφόνωση βενζολίου
Η αντίδραση σουλφόνωσης είναι πολύ δύσκολο να χρησιμοποιηθεί σε βιομηχανική κλίμακα επειδή είναι μια πολύ γρήγορη και ακραία εξώθερμη αντίδραση. Οι περισσότερες οργανικές ενώσεις σχηματίζουν μαύρο άνθρακα όταν έρχονται σε επαφή με τριοξείδιο του θείου λόγω αυτής της ταχείας αντίδρασης και σχηματισμού θερμότητας. Το ιξώδες των οργανικών ενώσεων αυξάνεται επίσης πολύ όταν μετατρέπεται σε σουλφονικό οξύ μέσω σουλφόνωσης. Όταν το ιξώδες αυξάνεται, είναι δύσκολο να αφαιρεθεί η θερμότητα από το μίγμα της αντίδρασης. Επομένως, απαιτείται σωστή λειτουργία ψύξης. Εάν όχι, ενδέχεται να σχηματιστούν δυσμενή υποπροϊόντα από παρενέργειες. Για αυτούς τους λόγους, οι αντιδράσεις σουλφόνωσης βιομηχανικής κλίμακας απαιτούν ειδικό εξοπλισμό.
Από την άλλη πλευρά, η ταχύτητα της αντίδρασης σουλφόνωσης μπορεί να μετριαστεί ελέγχοντας την αντιδραστικότητα του τριοξειδίου του θείου. Αυτό μπορεί να γίνει με δύο τρόπους:
- Αραίωση
- Συμπλέξιμο
Η συμπλοκοποίηση του τριοξειδίου του θείου μπορεί να γίνει με τις ακόλουθες μεθόδους.
- Παραγωγή σουλφαμικού οξέος με αντίδραση τριοξειδίου του θείου με αμμωνία
- Παραγωγή χλωροθειικού οξέος με αντίδραση τριοξειδίου του θείου με HCl
- Παραγωγή ελαίου με αντίδραση τριοξειδίου του θείου με νερό
Επομένως, η διαδικασία θείωσης μπορεί να πραγματοποιηθεί χρησιμοποιώντας μία ή μερικές από αυτές τις ενώσεις. Αλλά κατά την επιλογή του τύπου της ένωσης για τη διαδικασία σουλφόνωσης σε βιομηχανικές παραγωγές, θα πρέπει να λαμβάνονται υπόψη αρκετοί παράγοντες. Μερικά παραδείγματα δίνονται παρακάτω.
- Επιθυμητό τελικό προϊόν και η ποιότητά του
- Απαιτούμενη παραγωγική ικανότητα
- Κόστος αντιδραστηρίου
- Κόστος εξοπλισμού
- Κόστος διάθεσης απορριμμάτων.
Τι είναι η θείωση
Η θείωση είναι η αντικατάσταση ενός ατόμου υδρογόνου μιας οργανικής ένωσης με ένα θειικό (-OSO2 ΟΗ) λειτουργική ομάδα. Αυτή η διαδικασία περιλαμβάνει το σχηματισμό ενός δεσμού C-O-S. Αλλά το τελικό προϊόν (ονομάζεται θειικό ) δεν είναι σταθερό προϊόν. Αποσυντίθεται εύκολα για να σχηματίσει θειικό οξύ και μια άλλη ένωση. Επομένως, μετά την εξέλιξη της θείωσης, το σύστημα θα πρέπει να εξουδετερωθεί.
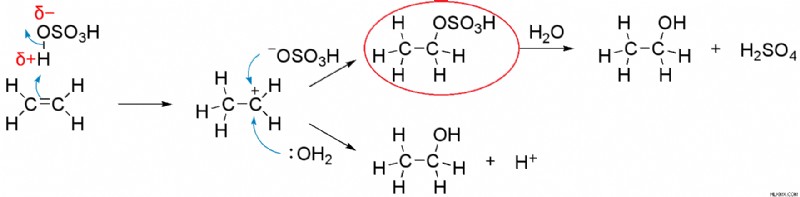
Εικόνα 2:Η Ένωση μέσα στον Κόκκινο Κύκλο είναι Προϊόν της Θειώσεως σε αυτό το Σύστημα.
Η παραπάνω εικόνα δείχνει μια αντίδραση θείωσης. Δεδομένου ότι το σύστημα δεν εξουδετερώνεται σωστά, το προϊόν της διαδικασίας θείωσης έχει αποσυντεθεί ξανά για να σχηματίσει θειικό οξύ. Τα θειικά, λόγω της αστάθειάς τους, είναι διαθέσιμα μόνο ως ουδέτερες ενώσεις.
Στη βιοχημεία, η θείωση είναι η καταλυόμενη από ένζυμα σύζευξη μιας σουλφο ομάδας σε ένα άλλο μόριο. Το ένζυμο που εμπλέκεται σε αυτή την αντίδραση ονομάζεται σουλφοτρανσφεράση.
Διαφορά μεταξύ σουλφόνωσης και θειοποίησης
Ορισμός
Σουλφόνωση: Η σουλφόνωση είναι η διαδικασία σύνδεσης της ομάδας σουλφονικού οξέος, –SO3 H, απευθείας σε άνθρακα σε οργανική ένωση.
Θίωση: Θείωση είναι η αντικατάσταση ενός ατόμου υδρογόνου μιας οργανικής ένωσης με ένα θειικό (-OSO2 OH) λειτουργική ομάδα.
Σχηματισμός δεσμού
Σουλφόνωση: Η σουλφόνωση σχηματίζει έναν δεσμό C-S.
Θίωση: Η θείωση σχηματίζει έναν δεσμό C-O-S.
Σταθερότητα
Σουλφόνωση: Το τελικό προϊόν της σουλφονίωσης είναι σταθερό.
Θίωση: Το τελικό προϊόν της θειοποίησης είναι ασταθές.
Ονομασία
Σουλφόνωση: Το τελικό προϊόν της σουλφονίωσης ονομάζεται σουλφονικό ή σουλφονικό οξύ.
Θίωση: Το τελικό προϊόν της σουλφόνωσης ονομάζεται θειικό.
Διαθεσιμότητα
Σουλφόνωση: Τα σουλφονικά είναι διαθέσιμα ως καθαρή ένωση που έχει απομονωθεί από το μίγμα της αντίδρασης.
Θίωση: Τα θειικά είναι διαθέσιμα μόνο ως ουδέτερες ενώσεις λόγω της αστάθειας.
Συμπέρασμα
Η σουλφόνωση και η θείωση είναι δύο σημαντικές χημικές διεργασίες που χρησιμοποιούνται σε πολλές βιομηχανίες για την προσθήκη μιας ομάδας που περιέχει θείο σε μια οργανική ένωση. Η κύρια διαφορά μεταξύ σουλφόνωσης και θείωσης είναι ότι η σουλφόνωση περιλαμβάνει το σχηματισμό ενός δεσμού C-S ενώ η θείωση περιλαμβάνει το σχηματισμό ενός δεσμού C-O-S.
Αναφορά:
1. «Σουλφονίωση». Encyclopædia Britannica, Encyclopædia Britannica, inc., 25 Φεβρουαρίου 2015, Διαθέσιμο εδώ.
2. «Σουλφονίωση». Dictionary.com, Dictionary.com, Διαθέσιμο εδώ.
3. «Η σουλφονίωση του βενζολίου». Chemistry LibreTexts, Libretexts, 2 Μαΐου 2017, Διαθέσιμο εδώ.
4. "Αυλάκωση." Wikipedia, Wikimedia Foundation, 1 Δεκεμβρίου 2017, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. "BenzeneSulfonation" Από τον V8rik στην Αγγλική Wikipedia (CC BY-SA 3.0) μέσω του Commons Wikimedia
2. «Ηλεκτρόφιλη αντίδραση θειικού οξέος με αιθένιο» του Calvero. – Selfmade with ChemDraw (Public Domain) μέσω Commons Wikimedia