Υβριδισμός Τριφθοριούχου Βρωμίου
Ο υβριδισμός εισήχθη για πρώτη φορά από τον Pauling για να εξηγήσει την ισοδύναμη φύση των δεσμών σε ένα μόριο. Μπορεί επίσης να περιγραφεί ως ο συνδυασμός διαφορετικών σχημάτων και ατομικών τροχιακών με περίπου ίση ενέργεια και η ανακατανομή της ενέργειας για τη δημιουργία νέων τροχιακών με το ίδιο σχήμα και ενέργεια. Αυτά τα νέα τροχιακά αναφέρονται ως υβριδικά τροχιακά και το φαινόμενο αναφέρεται ως υβριδισμός. Σε αυτό το άρθρο, θα μάθουμε για τον υβριδισμό του τριφθοριούχου βρωμίου μέσω του υβριδισμού του τριφθοριούχου βρωμίου.
BrF3
Το τριφθοριούχο βρώμιο ή BrF3 είναι μια ένωση διαλογόνων. Αυτό το μόριο περιέχει ένα βρώμιο και τρία άτομα φθορίου. Όλα αυτά τα άτομα στο μόριο έχουν υψηλές τιμές ηλεκτραρνητικότητας.
Το BrF3 έχει έντονη οσμή και εμφάνιση υγρού χρώματος αχύρου. Στη φύση, το BrF3 (τριφθοριούχο βρώμιο) είναι ένα πολικό μόριο επειδή η παρουσία δύο μεμονωμένων ζευγών στο άτομο βρωμίου προκαλεί την παραμόρφωση ή την κάμψη της μορφής του μορίου. Το μόριο BrF3 είναι πολικό επειδή η κατανομή φορτίου μεταξύ του βρωμίου και τριών ατόμων φθορίου δεν είναι ομοιόμορφη.
Ο Paul Lebeau συνθέτει αυτή την ένωση για πρώτη φορά το 1906, αντιδρώντας βρώμιο με φθόριο στους 20°C. Η ακόλουθη εξίσωση αντιπροσωπεύει την αντίδραση:
Br2 + 3F2 → 2BrF3
Το τριφθοριούχο βρώμιο μπορεί επίσης να παραχθεί με την ταυτόχρονη αναγωγή και οξείδωση του μονοφθοριούχου βρωμίου. Το τριφθοριούχο βρώμιο και το βρώμιο σχηματίζονται ως αποτέλεσμα αυτής της αντίδρασης.
3BrF→ BrF3 + Br2
Ιδιότητες του BrF3
Αυτή η ουσία έχει μονοϊσοτοπική μάζα 135,913547 u. (ενοποιημένες μονάδες ατομικής μάζας).
Το τριφθοριούχο βρώμιο έχει μοριακή μάζα 136,90 g/mol.
Είναι ένα υγρό με υψηλή υγροσκοπικότητα.
Το τριφθοριούχο βρώμιο έχει μοριακή μάζα 136,90 g/mol.
Αυτή η ουσία έχει μοριακή διπολική ροπή 1,19 Debye.
Η ουσία έχει πυκνότητα 2.803 g/cm3.
Το σημείο βρασμού αυτής της ουσίας είναι 125,72°C.
Το υγρό είναι καλός αγωγός του ηλεκτρισμού λόγω αυτοιονισμού.
Είναι εξαιρετικά διαβρωτικό υγρό.
Σε θερμοκρασία 68,0°F, το ειδικό βάρος του τριφθοριούχου βρωμίου είναι 2,81.
Αυτή η ουσία έχει μοριακή διπολική ροπή 1,19 Debye.
Υβριδισμός τριφθοριούχου βρωμίου
Για να αξιολογήσουμε τον υβριδισμό του τριφθοριούχου βρωμίου, θα εξετάσουμε πρώτα τη διαμόρφωση ηλεκτρονίων του κεντρικού ατόμου, του βρωμίου. Είναι γραμμένο ως εξής:
1s²2s²2p63s²3p⁶3d104s²4p⁵
Ωστόσο, ορισμένα ηλεκτρόνια στο βρώμιο μεταφέρονται σε τροχιακά 4d για να σχηματίσουν δεσμούς με το άτομο φθορίου. Επιπλέον, επειδή το φθόριο έχει υψηλότερη οξειδωτική ικανότητα, αναγκάζει το βρώμιο να προωθήσει τα ηλεκτρόνια στο εν λόγω επίπεδο. Το βρώμιο μπορεί τώρα να χρησιμοποιήσει τα d-τροχιακά για υβριδισμό.
Στο πιο εξωτερικό του κέλυφος, το BrF3 θα έχει επτά ηλεκτρόνια. Θα έχει επίσης δύο μεμονωμένα ζεύγη και τρεις ομοιοπολικούς δεσμούς Br-F μετά το σχηματισμό του δεσμού. Επειδή η τιμή υβριδισμού του ζεύγους ηλεκτρονίων είναι ίση με 5, σχηματίζονται υβριδικά τροχιακά sp3d.
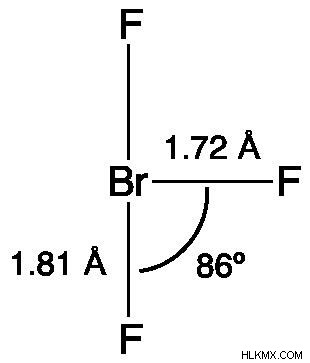
Δομή του BrF3
Η δομή Lewis του τριφθοριούχου βρωμίου αποκαλύπτει ότι έχει μοριακή δομή σε σχήμα Τ. Το κεντρικό βρώμιο συνδέεται με δύο ζεύγη ηλεκτρονίων, σύμφωνα με τη θεωρία του μοριακού σχηματισμού VSEPR. Η απόσταση μεταξύ του κέντρου βρωμίου και του ισημερινού φθορίου είναι 1,72 Α και η απόσταση μεταξύ του κέντρου βρωμίου και καθενός από τα αξονικά φθόριο είναι 1,81 Α. 86,2° είναι η γωνία που σχηματίζεται από το ισημερινό φθόριο και το αξονικό φθόριο. Επειδή η πίεση απώθησης από τους δεσμούς Br-F είναι μικρότερη από τη δύναμη των ζευγών ηλεκτρονίων, η γωνία διατηρείται ελαφρώς μικρότερη από 90°.
Πολικότητα BrF3
Το μόριο BrF3 ταξινομείται ως μη πολικό.
Λόγω της μεγάλης διαφοράς στην ηλεκτραρνητικότητα μεταξύ των ατόμων Br και F. Τα φορτία δεν κατανέμονται ομοιόμορφα σε όλο το μόριο.
Λόγω των μεμονωμένων ζευγών στο άτομο βρωμίου, το σχήμα του BrF3 είναι ασύμμετρο, γεγονός που συμβάλλει επίσης στην ανομοιόμορφη κατανομή φορτίου.
Τέτοια μη πολικά μόρια έχουν μη μηδενική καθαρή διπολική ροπή.
MOD του BrF3
Μπορείτε να χρησιμοποιήσετε ένα μοριακό τροχιακό διάγραμμα για να απεικονίσετε τη θέση και τη συμπεριφορά των ηλεκτρονίων στα μόρια. Ο σχηματισμός δεσμών μοναχικών ζευγών με ζεύγη ηλεκτρονίων σθένους επηρεάζει τις φυσικές ιδιότητες του μορίου. Αυτή η συνάρτηση προσδιορίζει το σχήμα του υβριδισμού βρίσκοντας το ηλεκτρόνιο στη συγκεκριμένη περιοχή του όταν αυτά σχηματίζουν δεσμούς.
Η θεωρία MO ασχολείται με τις ενεργειακές και χωρικές ιδιότητες ενός ζεύγους ηλεκτρονίων. Συζητά επίσης πώς τα ατομικά τροχιακά συνδυάζονται γραμμικά για να σχηματίσουν μοριακά τροχιακά.
Πώς να γράψετε τον τύπο του BrF3;
Πόσα ηλεκτρόνια σθένους έχει ένα μόριο BrF3; Το Br και το F είναι και τα δύο αλογόνα στην ομάδα 7 του περιοδικού πίνακα.
Σαν αποτέλεσμα, και τα δύο αυτά στοιχεία έχουν σθένος 7. Ο συνολικός αριθμός ηλεκτρονίων σθένους του BrF3
=7 + 7*3
=7 + 21
=28.
Ποιο άτομο θα χρησιμεύσει τώρα ως κεντρικό άτομο;
Κρατάμε το λιγότερο ηλεκτραρνητικό στοιχείο στο κέντρο κατά γενικό κανόνα. Σύμφωνα με το διάγραμμα ηλεκτραρνητικότητας, το βρώμιο έχει τιμή ηλεκτραρνητικότητας 2,96 ενώ το F έχει τιμή 3,98. Τώρα, θα τυλίξουμε τα 28 ηλεκτρόνια σθένους γύρω από τα άτομα για να ολοκληρώσουμε την οκτάδα. Κάθε άτομο σε αυτό το σύστημα έχει πλέον μια οκτάδα. Καθένα από τα τρία άτομα F και Br.
Για να προσδιορίσουμε εάν αυτός είναι ο καλύτερος σχηματισμός Lewis Structure του BrF3, πρέπει πρώτα να κατανοήσουμε μια άλλη έννοια:την επίσημη χρέωση. Το φορτίο που αποδίδεται στα συστατικά άτομα ενός χημικού μορίου όταν ο δεσμός μοιράζεται εξίσου μεταξύ όλων των ατόμων που υπάρχουν είναι γνωστό ως επίσημο φορτίο.
Για να σχηματίσουμε μια δομή Lewis, πρέπει πρώτα να προσδιορίσουμε εάν όλα τα άτομα έχουν τις χαμηλότερες δυνατές τυπικές τιμές φορτίου.
Ας κάνουμε τα μαθηματικά για το BrF3:
Τυπική χρέωση =7- 0,5* 2 -6 =0
Br:Επίσημη χρέωση =7-0,5*6-4 =0
Μπορούμε να δούμε ότι η τυπική τιμή φορτίου των τριών ατόμων F και του απλού ατόμου Br είναι μηδέν. Ως αποτέλεσμα, μπορούμε να συμπεράνουμε ότι έχουμε ήδη αποκτήσει το καταλληλότερο διάγραμμα LS.
Συμπέρασμα
Αυτό το άρθρο εξηγεί τον υβριδισμό του τριφθοριούχου βρωμίου μέσω του υβριδισμού των σημειώσεων τριφθοριούχου βρωμίου. Ο υβριδισμός του BrF3 είναι sp³d και η δομή του είναι σχήματος Τ ή τριγωνική διπυραμιδική. Το τριφθοριούχο βρώμιο είναι ένα μη πολικό μόριο. Μπορείτε να γράψετε τον τύπο του BrF3 μέσω των βημάτων που αναφέρονται παραπάνω.




