Άτομα αλογόνου κατά μήκος της αλυσίδας των ατόμων άνθρακα
Στον περιοδικό πίνακα, το άτομο αλογόνου βρίσκεται στη 17η ομάδα του περιοδικού πίνακα. Τα στοιχεία αλογόνου που εμφανίζονται σε αυτήν την ομάδα είναι Φθόριο, Χλώριο, Βρώμιο, Ιώδιο, Τεννεσίνη και Αστατίνη. Τώρα, αυτά τα συγκεκριμένα στοιχεία χρησιμοποιούνται ως άτομα σε μια αλυσίδα ατόμων άνθρακα ή, δηλαδή, αυτό που ονομάζουμε ενώσεις άνθρακα που περιέχουν αλογόνα.
Έτσι, τα παράγωγα αλογόνου είναι ενώσεις στις οποίες ίσος αριθμός ατόμων αλογόνου υποκαθίσταται στη θέση των ατόμων υδρογόνου ενός υδρογονάνθρακα. Τα παράγωγα αλογόνου των αλκανίων ονομάζονται αλογονοαλκάνια. Στα αλκυλαλογονίδια, το άτομο αλογόνου και το άτομο άνθρακα συγκρατούνται μαζί σχηματίζοντας έναν μόνο ομοιοπολικό δεσμό.
Σημασία θέσης ατόμου αλογόνου ή ένωση άνθρακα που περιέχει αλογόνο:
Το άτομο άνθρακα στους υδρογονάνθρακες με άτομα υδρογόνου συνδεδεμένα σε αυτό αντικαθίσταται από ένα άτομο αλογόνου, ένα από αυτά τα στοιχεία, F, Cl, Br ή I. Αυτές οι νέες ενώσεις που σχηματίζονται, οι οποίες έχουν στοιχεία αλογόνου συνδεδεμένα σε αυτές, είναι γνωστές ως αλογονοαλκάνια και αλογονοαρένια. Τα ονομάζουμε παράγωγα αλογόνου και αυτά τα συγκεκριμένα παράγωγα δεν απαντώνται φυσικά. Επομένως, συντίθενται στο εργαστήριο. Χρησιμοποιούνται ευρέως για βιομηχανικές και οικιακές χρήσεις. Χρήσεις όπως βιομηχανικοί διαλύτες, που χρησιμοποιούνται στην παραγωγή φαρμακευτικών προϊόντων. Υπάρχουν πολλές άλλες χρήσεις, όπως ένα στεγνό καθαριστικό, ένα αναισθητικό στην ιατρική, ένα φυτοφάρμακο κ.λπ.
Η ένωση της οποίας τα μόρια περιέχουν μία ομάδα αλογόνου (Cl 一 ή Br 一 ή I 一 ή F 一) που συνδέονται άμεσα με την αλυσίδα αλκυλίου είναι γνωστά ως αλκυλαλογονίδια ή μονοαλογόνα παράγωγα αλκανίων. Ανάλογα με το άτομο άνθρακα (δηλαδή 1, 2, 3, 3) που περιέχουν το άτομο αλογόνου. Τα αλκυλαλογονίδια μπορούν κυρίως να χωριστούν σε τρεις τύπους με βάση τη θέση του ατόμου αλογόνου κατά μήκος της αλυσίδας του άνθρακα, δηλαδή πρωτοταγών, δευτεροταγών και τριτοταγών αλογονιδίων. Αντιπροσωπεύονται από τον τύπο RX ή
 CnH2n+1X
CnH2n+1X
” width=”72″ height=”17″ />
όπου X 一 είναι η ομάδα halo. Για παράδειγμα, 1-χλωροπροπάνιο  CH3CH2CH2Cl
CH3CH2CH2Cl
” width=”103″ height=”17″ />
Τα αλογονοαλκάνια ονομάζονται μονο, δι, τρι, τετρα κ.λπ., ανάλογα με τη θέση του ατόμου αλογόνου, που είναι, όταν τα μόρια περιέχουν ένα, δύο, τρία, τέσσερα κ.λπ., άτομα αλογόνου στα μόρια, αντίστοιχα. Η θέση του ατόμου αλογόνου προκαλεί διακυμάνσεις στις ιδιότητες των αλογονοαλκανίων, όπως η διαλυτότητα του αλογονοαλκανίου, τα σημεία βρασμού και ο χαρακτήρας των δεσμών.
Ισομέρεια σε αλκυλαλογονίδια
Τα αλκυλαλογονίδια δείχνουν τους ακόλουθους τρεις τύπους ισομέρειας.
Ισομέρεια αλυσίδας:
Αυτός ο τύπος ισομερισμού οφείλεται σε διαφορές στη διάταξη των ατόμων άνθρακα στην αλυσίδα. Τα τρία πρώτα μέλη δεν το παρουσιάζουν αυτό αλλά εμφανίζονται μόνο από ανώτερα μέλη. Έτσι, σε αυτόν τον τύπο ισομερισμού, η θέση του ατόμου αλογόνου παραμένει αμετάβλητη.
Για παράδειγμα:
Το ισομερές αλυσίδας του 1-χλωροβουτανίου  είναι
είναι
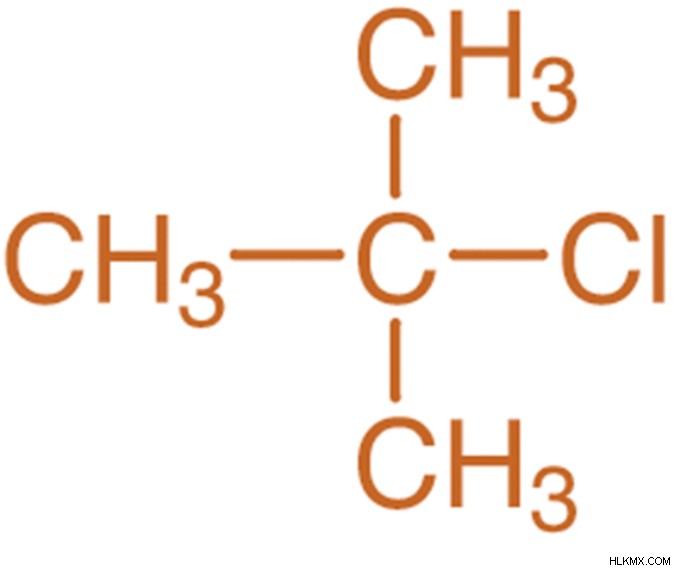
1-χλωρο-2-μεθυλοπροπάνιο
Ισομερισμός θέσης:
Σε αυτόν τον τύπο ισομερισμού, τα ισομερή διαφέρουν ως προς τη θέση του ατόμου αλογόνου. Έτσι, η θέση του ατόμου αλογόνου αλλάζει.
Για παράδειγμα:
Το ισομερές θέσης του 1-χλωροβουτανίου  είναι
είναι
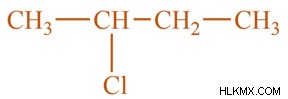
2-χλωροβουτάνιο
Οπτικός ισομερισμός:
Αυτός ο τύπος ισομέρειας παρουσιάζεται από αλκυλαλογονίδια που έχουν χειρόμορφη δομή (μόρια με μη υπερτιθέμενες κατοπτρικές εικόνες ). Έτσι, σε αυτή την περίπτωση, η θέση του ατόμου αλογόνου αλλάζει μαζί με τα μόρια των υδρογονανθράκων.
Για παράδειγμα,
Το 2-χλωροβουτάνιο εμφανίζει εναντιομερισμό και τα δύο εναντιομερή είναι:
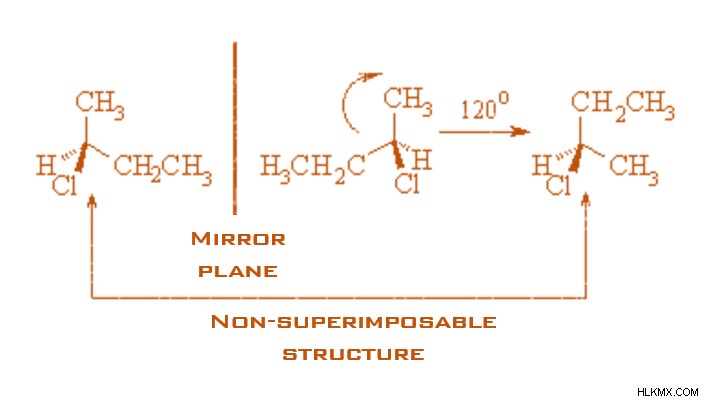
Εναντιομερή του 2-χλωροβουτανίου
Ταξινόμηση αλκυλοαλογονιδίων ή αλογονοαλκανίων:
Τα αλογονοαλκάνια μπορούν να χωριστούν σε τρεις κατηγορίες με βάση τη θέση του ατόμου αλογόνου στην αλυσίδα των ατόμων άνθρακα.
Πρωτογενή Αλογονοαλκάνια:
Τα πρωτογενή αλογονοαλκάνια είναι οι ενώσεις στις οποίες το άτομο αλογόνου συνδυάζεται απευθείας με μία ομάδα αλκυλίου. Έτσι, το άτομο αλογόνου συνδυάζεται με την ομάδα CH2 που συγκρατεί το άτομο αλογόνου μέσω ενός μόνο δεσμού εκτός από το CH3Br και άλλα μεθυλαλογονίδια, καθώς δεν υπάρχει αλκυλομάδα στην οποία το αλογόνο είναι συνδεδεμένο με την ομάδα CH2.
Για παράδειγμα:

Δευτερεύοντα αλοαλκάνια:
Δευτερεύοντα αλογονοαλκάνια είναι τα αλκυλαλογονίδια στα οποία το άτομο αλογόνου είναι τοποθετημένο σε άλλες δύο ομάδες αλκυλίου κατά μήκος της αλυσίδας ατόμων άνθρακα σε δύο άλλες αλκυλομάδες. Αυτές οι αλκυλομάδες συνδυάζουν τους ίδιους ή διαφορετικούς τύπους της αλκυλομάδας.
Για παράδειγμα:
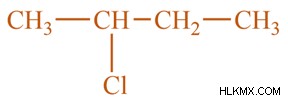
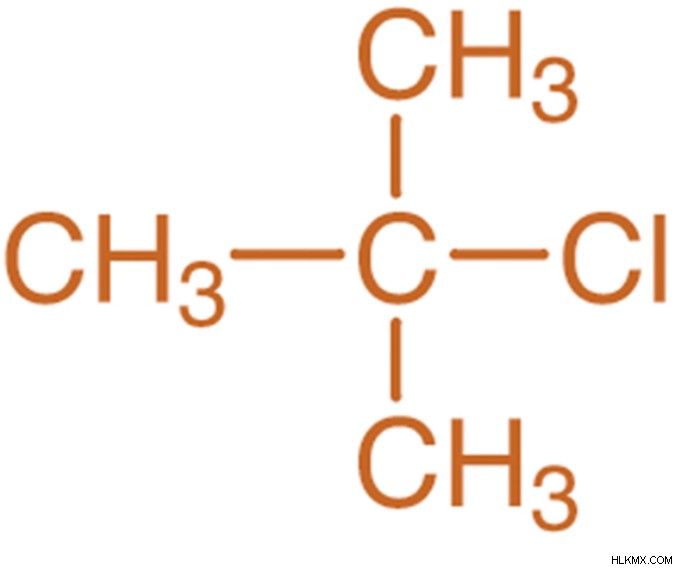
Τριτοταγή Αλογονοαλκάνια:
Τα τριτοταγή αλογονοαλκάνια είναι τα αλκυλαλογονίδια στα οποία το άτομο αλογόνου είναι τοποθετημένο σε τρεις ομάδες αλκυλίου κατά μήκος της αλυσίδας άτομα άνθρακα σε δύο άλλες ομάδες αλκυλίου. Αυτές οι αλκυλομάδες συνδυάζουν τους ίδιους ή διαφορετικούς τύπους της αλκυλομάδας.
Για παράδειγμα:
Συμπέρασμα:
Εδώ, μάθαμε ότι τα αλκυλαλογονίδια είναι οι ενώσεις που περιέχουν ένα άτομο αλογόνου κατά μήκος της αλυσίδας του αλκυλομάδα. Η μελέτη της θέσης του ατόμου αλογόνου και των ιδιοτήτων του ατόμου αλογόνου που υπάρχει στο αλκυλαλογονίδιο είναι τεράστιας σημασίας, καθώς αποφασίζει διαφορετικές φυσικές ιδιότητες όπως σημεία τήξης και βρασμού (για ισομερή αλκυλαλογονίδια, τα σημεία βρασμού μειώνονται καθώς αυξάνεται η διακλάδωση, ίδιο αλογόνο, τα σημεία βρασμού μειώνονται καθώς αυξάνεται το μέγεθος της αλκυλομάδας), Πυκνότητα, Ισχύς δεσμού, Διπολικές ροπές, Σταθερότητα και Διαλυτότητα.




