Αρχή αποκλεισμού Pauli
Ορισμός της αρχής εξαίρεσης Pauli
Η Αρχή Αποκλεισμού Pauli δηλώνει ότι σε οποιοδήποτε άτομο κανένα ηλεκτρόνιο δεν μπορεί να έχει τους ίδιους τέσσερις ηλεκτρονικούς κβαντικούς αριθμούς με ένα άλλο ηλεκτρόνιο. Κάθε ηλεκτρόνιο πρέπει να έχει διαφορετικούς κβαντικούς αριθμούς. Έτσι, σε κάθε ηλεκτρονικό τροχιακό (ίδιο n , l, και ml ) μπορεί να υπάρχουν δύο ηλεκτρόνια και πρέπει να έχουν διαφορετικά σπιν. Ένα ηλεκτρόνιο θα έχει ms =+ ½ και τα άλλα ms =– ½. Επομένως, κανένα ηλεκτρόνιο δεν θα έχει τους ίδιους τέσσερις κβαντικούς αριθμούς.
Ο κβαντικός αριθμός σπιν (ms ) προστέθηκε στους τρεις κβαντικούς αριθμούς που ανακαλύφθηκαν προηγουμένως (n , l , ml ) από την αρχή του αποκλεισμού Pauli. Ένα θετικό ms συνήθως υποδεικνύει spin up και αντιπροσωπεύεται από ένα βέλος που δείχνει προς τα πάνω. Ένα αρνητικό ms συνήθως υποδεικνύει περιστροφή προς τα κάτω και αντιπροσωπεύεται από ένα βέλος που βλέπει προς τα κάτω. Ο κβαντικός αριθμός σπιν είναι ελαφρώς διαφορετικός από τους άλλους κβαντικούς αριθμούς επειδή δεν εξαρτάται από αυτούς. Μπορεί να έχει μόνο μια τιμή + ½ ή – ½ και αυτές οι τιμές είναι ανεξάρτητες από όλους τους άλλους κβαντικούς αριθμούς. Οι άλλοι κβαντικοί αριθμοί είναι όλοι διασυνδεδεμένοι.

Η αρχή ορίζει επίσης ότι κάθε τροχιακό μπορεί να έχει μόνο δύο ηλεκτρόνια. Αυτός ο ορισμός προέρχεται από ένα τροχιακό που ορίζεται από τους τρεις πρώτους κβαντικούς αριθμούς. Ο υπόλοιπος αριθμός κβαντικού σπιν έχει μόνο δύο πιθανές τιμές. Επομένως, σύμφωνα με τον ορισμό της αρχής αποκλεισμού Pauli, το τροχιακό μπορεί να κρατήσει μόνο δύο ηλεκτρόνια.
Fermions εναντίον Bosons
Αυτή η αρχή ισχύει για όλα τα φερμιόνια. Ένα φερμιόνιο είναι ένα ατομικό σωματίδιο που έχει μισό ακέραιο σπιν. Κοινώς γνωστά φερμιόνια είναι τα ηλεκτρόνια, τα πρωτόνια και τα νετρόνια. Επομένως, όλα αυτά τα σωματίδια θα ακολουθούν την αρχή του αποκλεισμού Pauli.
Η εναλλακτική λύση για ένα φερμιόνιο είναι ένα μποζόνιο. Τα μποζόνια έχουν περιστροφές ακέραιων αριθμών. Το πιο κοινό μποζόνιο είναι ένα φωτόνιο. Μπορεί να υπάρχουν πολλά φωτόνια σε μία ενεργειακή κατάσταση. Σε μια κατάσταση, όλα έχουν τον ίδιο κβαντικό αριθμό. Πρόκειται για παραβίαση του κανόνα αποκλεισμού Pauli. Επειδή τα φωτόνια είναι μποζόνια, ωστόσο, δεν ακολουθούν τον κανόνα αποκλεισμού Pauli.
Εφαρμογές της αρχής αποκλεισμού Pauli στη χημεία
Η αρχή αποκλεισμού Pauli είναι σημαντική κατά τον προσδιορισμό της δομής του κελύφους ηλεκτρονίων ενός ατόμου. Συνδυάζεται με την αρχή Aufbau για να μας επιτρέψει να γνωρίζουμε ποια τροχιακά ηλεκτρονίων θα γεμίσουν. Χρησιμοποιώντας την αρχή του αποκλεισμού Pauli γνωρίζουμε ότι εάν υπάρχουν δύο ηλεκτρόνια σε ένα τροχιακό, το ένα πρέπει να σπινάρει προς τα πάνω (+ ½ ) και ένα πρέπει να σπιν προς τα κάτω (- ½ ) για να τους δώσει διαφορετικούς κβαντικούς αριθμούς. Ωστόσο, εάν υπάρχει μόνο ένα ηλεκτρόνιο σε ένα τροχιακό, μπορεί να έχει είτε θετικό είτε αρνητικό σπιν.
Η ανακάλυψη της αρχής του αποκλεισμού Pauli βοήθησε επίσης να εξηγηθούν ορισμένα φαινόμενα στον περιοδικό πίνακα και οι λόγοι πίσω από τον τρόπο σύνδεσης ορισμένων ατόμων. Ιδιαίτερα για τα στερεά, πολλές από τις προηγουμένως ανεξήγητες ιδιότητες μπορούσαν να εξηγηθούν χρησιμοποιώντας την αρχή του αποκλεισμού Pauli.
Παράδειγμα προβλημάτων
Ήλιο
Το πιο απλό άτομο για να δούμε είναι το ήλιο. Το ήλιο έχει δύο ηλεκτρόνια στο τροχιακό 1s. Το τροχιακό 1s έχει κβαντικούς αριθμούς n =1, l =0 και ml =0. Και τα δύο ηλεκτρόνια θα βρίσκονται σε αυτό το υποκέλυφος. Επομένως, ένα ηλεκτρόνιο θα έχει κβαντικούς αριθμούς n =1, l =0, ml =0 και ms =+1/2. Το άλλο ηλεκτρόνιο θα έχει κβαντικούς αριθμούς n =1, l =0, ml =0 και ms =-1/2.

Βηρύλλιο
Το βηρύλλιο έχει τέσσερα ηλεκτρόνια που γεμίζουν τα τροχιακά 1s και 2s. Παρακάτω είναι μερικά παραδείγματα διαμορφώσεων ηλεκτρονίων που θα παραβίαζαν την Αρχή αποκλεισμού Pauli καθώς και τη σωστή απεικόνιση.
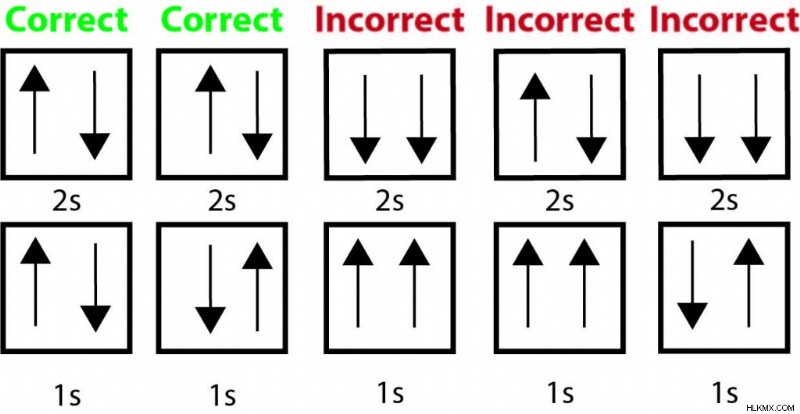
Όλες οι λανθασμένες επιλογές έχουν βέλη που δείχνουν με τον ίδιο τρόπο (που υποδεικνύουν την ίδια περιστροφή) στο ίδιο τροχιακό. Αυτό υποδηλώνει ότι θα είχαν τους ίδιους τέσσερις κβαντικούς αριθμούς και θα παραβίαζαν την αρχή του αποκλεισμού Pauli.
Στη συνέχεια, μπορούμε επίσης να απαριθμήσουμε τους κβαντικούς αριθμούς για κάθε ηλεκτρόνιο για να δούμε ότι κανένα ηλεκτρόνιο δεν έχει τους ίδιους 4 κβαντικούς αριθμούς.
Ξεκινάμε γεμίζοντας το κέλυφος 1s. Αυτό σημαίνει ότι ο κύριος κβαντικός αριθμός n ισούται με 1. Και το s-τροχιακό συμβολίζεται με την τιμή 0 στο l .
- Ηλεκτρόνιο 1:n =1, l =0, ml =0 και ms =– ½
- Electron 2:n =1, l =0, ml =0 και ms =+ ½
Αυτό γεμίζει το κέλυφος 1s. Το επόμενο κέλυφος είναι το 2s, το οποίο αλλάζει τον κύριο κβαντικό αριθμό n έως 2.
- Ηλεκτρόνιο 3:n =2, l =0, ml =0 και ms =– ½
- Ηλεκτρόνιο 4:n =2, l =0, ml =0 και ms =+ ½
Συγκρίνοντας τους κβαντικούς αριθμούς και των τεσσάρων ηλεκτρονίων, κανένα από αυτά δεν είναι ίδιο. Συμπερασματικά, ακολουθούν την αρχή του αποκλεισμού Pauli.
Ιστορία της αρχής του αποκλεισμού Pauli
Η αρχή του αποκλεισμού Pauli ανακαλύφθηκε από τον Wolfgang Pauli το 1925. Αυτή η αρχή επεκτάθηκε στο μοντέλο Bohr. Την εποχή που ανακαλύφθηκε για πρώτη φορά η αρχή, την εφάρμοσε μόνο στα ηλεκτρόνια. Αργότερα, η αρχή επεκτάθηκε σε όλα τα φερμιόνια το 1940 από τον Pauli.
Ο Βόλφγκανγκ Πάουλι έλαβε το βραβείο Νόμπελ φυσικής το 1945 για τις ανακαλύψεις και το έργο του στην κβαντική χημεία. Εργάστηκε επίσης στην προσπάθεια να εξηγήσει το φαινόμενο Zeeman και πρότεινε την ύπαρξη του νετρίνου. Ο Pauli γεννήθηκε στην Αυστρία το 1900 και πέθανε το 1958.