Ισομερισμός σε Συντονιστικές Ενώσεις
Ισομερή μιας ένωσης μπορούν να οριστούν ως μόρια που έχουν τον ίδιο χημικό τύπο αλλά διαφορετικό χωρικό προσανατολισμό ή δομικές διατάξεις.
Ας πάρουμε το παράδειγμα ενός απλού οργανικού μορίου – του πεντανίου (C5H12).
H3C – CH2 – CH2 – CH2 – CH3 (ευθεία αλυσίδα)
H3C – CH (CH3)- CH2 – CH3 (διακλαδισμένη αλυσίδα στην οποία συνδέεται μία ομάδα μεθυλίου σε δεύτερος άνθρακας από τα αριστερά)
H3C – C(CH3)2 – CH3 (υπάρχει ένα άτομο άνθρακα στο οποίο ανήκουν τέσσερις ομάδες μεθυλίου επισυνάπτεται)
Όλα τα παραπάνω είναι ισομερή πεντανίου που έχουν τον ίδιο χημικό τύπο αλλά διαφορετικές δομές.
Η ισομέρεια μπορεί να είναι δύο τύπων—δομική ισομέρεια και στερεοϊσομέρεια. Στην πρώτη, ο χημικός τύπος είναι ο ίδιος, αλλά οι δεσμοί μορίων και ατόμων μπορεί να είναι διαφορετικοί, όπως φαίνεται στο παράδειγμα του πεντανίου.
Στο στερεοϊσομερισμό όμως υπάρχει διαφορά μόνο στη χωρική διάταξη. Η στερεοϊσομέρεια μπορεί περαιτέρω να χωριστεί σε γεωμετρική και οπτική ισομέρεια.
Γεωμετρικός ισομερισμός σε σημειώσεις ενώσεων συντονισμού
Πρέπει να προσκολληθούν περισσότερα από ένα είδη συνδέτη στο μέταλλο, δηλαδή, η ένωση πρέπει να είναι ετερόληπτική.
Τετράγωνες επίπεδες ενώσεις της μορφής AB2C2:
Υπάρχουν σε μορφές cis και trans. Trans είναι όταν ο ίδιος συνδετήρας είναι αντίθετος μεταξύ τους.
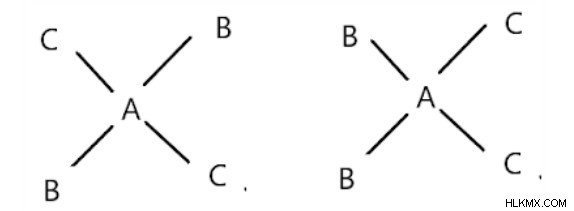
Μεταφορά φόρμας Cis
Η πρώτη δομή είναι trans και η δεύτερη είναι cis.
Ας πάρουμε το παράδειγμα του [Pt(NH3)2Cl2]
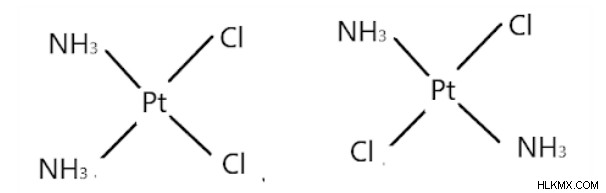
Φόρμα Cis Transform
Η πρώτη ένωση είναι cis-διαμινοδιχλωροπλατίνα (II). Δύο ιόντα χλωρίου είναι γειτονικά μεταξύ τους και δύο μόρια αμίνης είναι γειτονικά μεταξύ τους επίσης.
Η δεύτερη ένωση είναι η trans-διαμινοδιχλωροπλατίνα (II). Τα δύο μόρια αμίνης και χλωρίου τοποθετούνται το ένα απέναντι στο άλλο, αντίστοιχα.
Οκταεδρικές ενώσεις της μορφής AB2C4:
Υπάρχουν σε μορφές cis και trans ανάλογα με τη θέση του B. Εάν το B είναι απέναντι το ένα από το άλλο, παίρνουμε trans-ισομερές. Διαφορετικά, παίρνουμε cis-ισομερές.
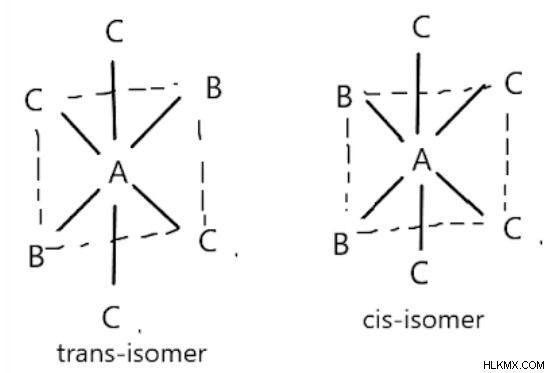
Η ένωση [Co(NH3)4Cl2]+ είναι μια οκταεδρική ένωση που υπάρχει στις μορφές cis και trans. Το πρώτο σχήμα αντιπροσωπεύει το cis-ισομερές και το δεύτερο δείχνει το trans-ισομερές της ένωσης.

Οκταεδρικές ενώσεις της μορφής AB3C3:
Υπάρχουν σε μορφές fac και mer. Η μορφή Fac είναι όταν ένας συνδέτης υπάρχει στις γειτονικές κορυφές του οκταεδρικού. Στη μορφή mer, ένα ζεύγος προσδεμάτων του ίδιου τύπου θα ήταν απέναντι ο ένας στον άλλο, όπως στο αριστερό σχήμα. Οι συνδέτες λέγεται ότι είναι τοποθετημένοι γύρω από τον μεσημβρινό του πολυέδρου, όπως στο δεξιό σχήμα.
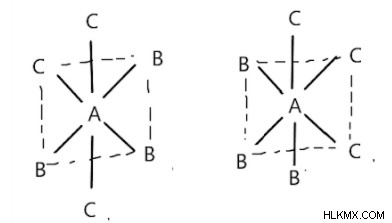
Ισομερές Mer ισομερές Fac
[Co(NH3)3(NO2)3] υπάρχει σε μορφή fac και mer ως εξής:
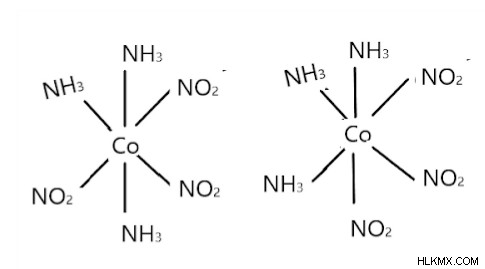
Το αριστερό είναι mer και το δεξί είναι fac.
Οπτικός ισομερισμός στις σημειώσεις ενώσεων συντονισμού
Οπτικά ισομερή των ενώσεων συντονισμού είναι οι μη υπερτιθέμενες κατοπτρικές εικόνες. Παρατηρείται συνηθέστερα σε εκείνες τις οκταεδρικές ενώσεις που έχουν διοδικούς συνδέτες συντονισμένους με το κεντρικό μεταλλικό ιόν. Για παράδειγμα:[Co(en)3]3+
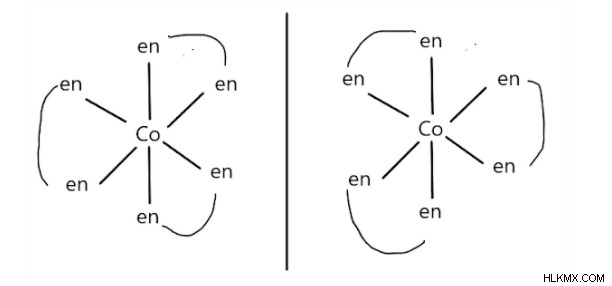
Το αριστερό ισομερές είναι dextro (περιστρέφει το επίπεδο του πολωμένου φωτός προς τη σωστή κατεύθυνση) και το δεξιό ισομερές είναι laevo (περιστρέφει το επίπεδο του πολωμένου φωτός προς την αριστερή κατεύθυνση).
Δομικός ισομερισμός σε ενώσεις συντονισμού
Μπορεί να ταξινομηθεί περαιτέρω στους ακόλουθους τύπους:
Ισομερισμός σύνδεσης
Ισομερισμός συντονισμού
Ισομερισμός ιονισμού
Ισομέρεια διαλυμάτων
Ισομερισμός σύνδεσης σε ενώσεις συντονισμού
Αυτός ο τύπος ισομέρειας υπάρχει σε σύμπλοκα που έχουν ένα αμφεντικό συνδετήρα. Ο συνδέτης μπορεί να συντονιστεί με το μεταλλικό ιόν μέσω δύο θέσεων δότη. Ένα παράδειγμα αμμιδιαντικού συνδετήρα είναι το θειοκυανικό (SCN-), το οποίο μπορεί να συντονίζεται μέσω ατόμου αζώτου ή ατόμου θείου (NCS-).
Ισομερισμός συντονισμού σε ενώσεις συντονισμού
Υπάρχει σε ενώσεις που έχουν δύο σφαίρες συντονισμού – μία κατιονική και μία ανιονική. Μπορούν να ανταλλάσσονται συνδετήρες μεταξύ των δύο οντοτήτων. Ένα παράδειγμα είναι το [Co(NH3)6][Cr(CN)6]. Σε αυτό, η σφαίρα συντονισμού με το Co είναι κατιονική και η άλλη είναι ανιονική. Ωστόσο, μόλις ανταλλάσσονται οι συνδέτες, παίρνουμε [Cr(NH3)6][Co(CN)6].
Ισομέρεια ιονισμού σε ενώσεις συντονισμού
Συμβαίνει όταν το ιόν έξω από τη σφαίρα συντονισμού αντικαθιστά έναν συνδετήρα απευθείας συνδεδεμένο με το μεταλλικό κέντρο. Το [Co(NH3)5(SO4)]Br έχει βρωμίδιο ως αντισταθμιστικό ιόν. Ωστόσο, το Br- μπορεί να αντικαταστήσει το θειικό άλας μέσα στη σφαίρα συντονισμού για να δώσει [Co(NH3)5Br]SO4.
Ισομέρεια διαλυμάτων σε ενώσεις συντονισμού
Είναι ένας τύπος ισομερισμού ιονισμού στον οποίο ο διαλύτης δρα ως πρόσδεμα. Για παράδειγμα, στο [Cr(H2O)6]Cl3, ένα αντισταθμιστικό ανιόν χλωρίου μπορεί να αντικαταστήσει έναν από τους υδάτινους συνδέτες και να γίνει [Cr(H2O)5Cl]Cl.H2O
Συμπέρασμα
Η ισομέρεια στις ενώσεις συντονισμού μπορεί να είναι δύο τύπων – δομική ισομέρεια και στερεοϊσομέρεια. Στερεοϊσομερισμός είναι όταν τα ισομερή είναι διαφορετικά ως προς τη χωρική διάταξη. Μπορεί και πάλι να είναι δύο τύπων – γεωμετρικό και οπτικό. Τα γεωμετρικά ισομερή μπορούν να υπάρχουν σε μορφές cis και trans ή σε μορφές fac και mer. Η δομική ισομέρεια μπορεί να ταξινομηθεί σε τέσσερις τύπους - ισομέρεια σύνδεσης, ισομέρεια συντονισμού, ισομέρεια ιονισμού και ισομέρεια διαλυτωμάτων.




