Διαφορά μεταξύ αριθμού μάζας και ατομικής μάζας
Κύρια διαφορά – Αριθμός μάζας έναντι ατομικής μάζας
Τόσο ο αριθμός μάζας όσο και η ατομική μάζα σχετίζονται πολύ στενά μεταξύ τους και υποδηλώνουν το βάρος των στοιχείων. Διαφέρουν στον τρόπο με τον οποίο ορίζονται. Η κύρια διαφορά μεταξύ μαζικού αριθμού και ατομικής μάζας είναι ότι ο μαζικός αριθμός ασχολείται με μεμονωμένα άτομα που λαμβάνονται υπόψη ξεχωριστά ενώ η ατομική μάζα ασχολείται με τον σταθμισμένο μέσο όρο του στοιχείου συμπεριλαμβανομένων των ισοτόπων του.
Τι είναι ο μαζικός αριθμός
Όπως αναφέρθηκε παραπάνω, ο μαζικός αριθμός σχετίζεται με το βάρος ενός μεμονωμένου ατόμου που εξετάζουμε. Ένα άτομο αποτελείται από έναν πυρήνα και τροχιακά γύρω από αυτόν. Αυτά τα τροχιακά υπάρχουν στον ελεύθερο χώρο και φιλοξενούν ηλεκτρόνια. Ωστόσο, το βάρος των ηλεκτρονίων είναι αμελητέο σε σύγκριση με τον πυρηνικό πυρήνα. Επομένως, το βάρος των ηλεκτρονίων δεν συμβάλλει στο βάρος ενός ατόμου/στοιχείου. Ο πυρήνας αποτελείται από πρωτόνια και νετρόνια. Τόσο τα νετρόνια όσο και τα πρωτόνια έχουν σχεδόν το ίδιο βάρος αλλά αλλάζουν πολύ ελαφρά. Τα πρωτόνια είναι θετικά φορτισμένα και τα νετρόνια είναι ουδέτερα φορτισμένα. Επομένως, ο πυρήνας παραμένει θετικά φορτισμένος. Ωστόσο, το άτομο ως σύνολο θεωρείται ως ουδέτερες οντότητες καθώς το θετικό φορτίο από τα πρωτόνια εξουδετερώνεται από το αρνητικό φορτίο των ηλεκτρονίων. Ο αριθμός των ηλεκτρονίων σε ένα άτομο ισούται με τον αριθμό των πρωτονίων.
Τα στοιχεία στον περιοδικό πίνακα είναι διατεταγμένα σύμφωνα με έναν αυξανόμενο μαζικό αριθμό. Ο μαζικός αριθμός αναπαρίσταται συμβολικά στην επάνω αριστερή γωνία όταν ένα στοιχείο επισημαίνεται. Ο μαζικός αριθμός διαφέρει από τον ατομικό αριθμό καθώς αντιπροσωπεύει μόνο τον αριθμό των πρωτονίων ή των ηλεκτρονίων σε ένα στοιχείο. Και ο ατομικός αριθμός γράφεται συνήθως στην κάτω αριστερή γωνία ενός στοιχείου. 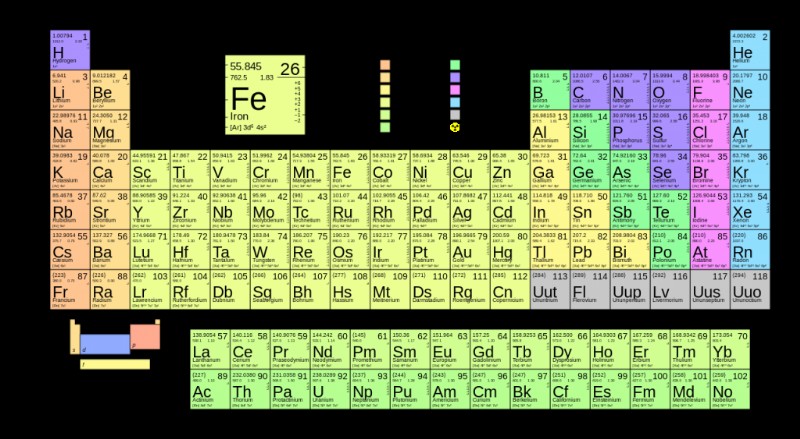
Τι είναι η ατομική μάζα
Αυτός ο όρος σχετίζεται πολύ στενά με τον μαζικό αριθμό. Στην πραγματικότητα σημαίνει το ίδιο πράγμα κυριολεκτικά, ωστόσο, σε αυτή την περίπτωση, υπολογίζονται και οι ισοτοπικές μορφές κάθε στοιχείου. Τα στοιχεία μπορούν να υπάρχουν σε διάφορες μορφές στη φύση. Αυτές οι διαφορετικές μορφές είναι γενικά γνωστές ως ισότοπα και έχουν την ίδια ταυτότητα με την πιο άφθονη/σταθερή μορφή του στοιχείου. Επομένως, τα ισότοπα έχουν τον ίδιο ατομικό αριθμό, αλλά έχουν διαφορετικούς αριθμούς μάζας. Μπορούμε να συμπεράνουμε ότι τα ισότοπα φέρουν την ίδια ποσότητα πρωτονίων και ηλεκτρονίων. Είναι μόνο ο αριθμός των νετρονίων που διαφέρει. Επομένως, αυτό που διαφέρει μεταξύ τους είναι το βάρος.
Όταν λαμβάνεται υπόψη κάθε ισοτοπική μορφή, η μάζα μιας στοιχειακής μορφής μπορεί να εκφραστεί ως μέση τιμή, όπου οι μεμονωμένες μάζες κάθε ισοτοπικής μορφής υπολογίζονται κατά μέσο όρο. Αυτό αναφέρεται ως «Ατομική Μάζα» ενός στοιχείου. Επομένως, η ατομική μάζα έχει σχεδόν την ίδια αριθμητική τιμή με τον μαζικό αριθμό, με μόνο μια αλλαγή λίγων δεκαδικών τιμών. Κάθε αριθμός χρησιμοποιείται για λόγους ευκολίας ανάλογα με το περιβάλλον χρήσης.

Διαφορά μεταξύ αριθμού μάζας και ατομικής μάζας
Ορισμός
Ο Μαζικός αριθμός είναι το βάρος του πυρήνα ενός ατόμου.
ΗΑτομική Μάζα είναι το μέσο βάρος μιας μορφής στοιχείου.
Σύμβολο
Ο Μαζικός αριθμός είναι γραμμένο στην επάνω αριστερή γωνία μιας στοιχειώδους έκφρασης.
Η Ατομική Μάζα δεν συμβολίζεται ως τέτοιο.
Εξέταση των ισοτόπων
Μαζικός αριθμός δεν λαμβάνει υπόψη την ύπαρξη ισοτόπων, καθώς σχετίζεται με το βάρος κάθε ατόμου ξεχωριστά.
Η Ατομική μάζα σχετίζεται με το μέσο βάρος μιας στοιχειακής μορφής και, ως εκ τούτου, λαμβάνει υπόψη την ύπαρξη ισοτόπων και την αφθονία τους.
Αριθμητική τιμή
Ο Μαζικός αριθμός είναι ένας απλοποιημένος αριθμός, συνήθως χωρίς δεκαδικά ψηφία.
ΗΑτομική Μάζα ασχολείται με πολλές δεκαδικές τιμές καθώς είναι ένας σταθμισμένος μέσος όρος.
Ευκολία χρήσης
Ο Μαζικός αριθμός είναι πιο εύκολο στη χρήση για γενικούς σκοπούς.
ΗΑτομική Μάζα είναι χρήσιμο όταν εκτελείτε συγκεκριμένους υπολογισμούς.





