Διαφορά μεταξύ ωσμωτικότητας και τονικότητας
Κύρια διαφορά – Οσμωτικότητα έναντι τονικότητας
Οι όροι Osmolarity και Tonicity συνδέονται στενά μεταξύ τους. Αναφέρονται στην έννοια των συγκεντρώσεων των διαλυμάτων και στο πώς επηρεάζουν την οσμωτική πίεση. Ωστόσο, ο τρόπος που εκφράζουν τα αποτελέσματά τους είναι διαφορετικός μεταξύ τους. Και οι δύο όροι σχετίζονται με καταστάσεις όπου τα διαλύματα διαχωρίζονται από διαπερατές μεμβράνες όπου λαμβάνει χώρα όσμωση. Η ωσμωτικότητα λαμβάνει υπόψη όλα τα μόρια που υπάρχουν στο διάλυμα για τη συλλογική της επίδραση ενώ, ητονικότητα λαμβάνει υπόψη μόνο τη συγκέντρωση των μη διαπερατών μορίων διαλυμένης ουσίας μέσα στο διάλυμα. Επομένως, μπορεί να ειπωθεί ότι η τονικότητα είναι ένα μέτρο του εξωτερικού περιβάλλοντος , ενώ η ωσμωτικότητα αφορά το ίδιο το διάλυμα που δίνεται . Αυτή είναι η κύρια διαφορά μεταξύ ωσμωτικότητας και τονικότητας.
Τι είναι η ωσμωτικότητα
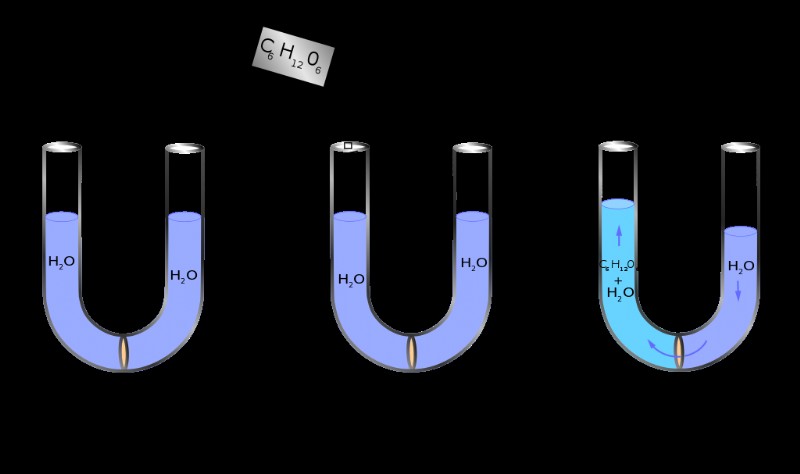
Η ωσμωτικότητα είναι ένας τρόπος έκφρασης της συγκέντρωσης ενός διαλύματος μέσω του αριθμού των οσμορίων που υπάρχουν στο διάλυμα και όχι με τον γνωστό τρόπο εξέτασης του αριθμού των γραμμομορίων σε ένα διάλυμα που αναφέρεται ως «μοριακότητα». Επομένως, αντί για τη μονάδα mol/L, όπως στην περίπτωση της μοριακότητας, η ωσμωτικότητα χρησιμοποιεί τις μονάδες ωσμοριακών μορίων διαλυμένης ουσίας ανά λίτρο ή osmol/L. Σε πολλές περιπτώσεις, η τιμή για την ωσμωτικότητα είναι παρόμοια με την τιμή της μοριακότητας, ωστόσο, στην περίπτωση των υδατοδιαλυτών ενώσεων, η ωσμωτικότητα γίνεται μεγαλύτερη από τη μοριακότητα του διαλύματος. Αυτό συμβαίνει επειδή, η ωσμωτικότητα περιλαμβάνει τη συνολική ποσότητα των διαλυμένων ουσιών που υπάρχουν ενώ η μοριακότητα περιλαμβάνει τη συγκέντρωση της ένωσης στο σύνολό της. Για παράδειγμα; Το NaCl μόλις διαλυθεί στο νερό διαχωρίζεται στα ιόντα του ως Na και Cl. Εάν το NaCl είχε συγκέντρωση 2 mol/L στην αρχή, κατά τη διάλυση στο νερό, η μοριακότητά του παραμένει 2 mol/L, αλλά η ωσμωτικότητά του αυξάνεται σε 4 osmol/L, λόγω της εξέτασης του συνολικού αριθμού των διαλυμένων ουσιών στο διάλυμα τώρα , τα οποία είναι τα διαχωρισμένα ιόντα. (2 osmol/L Na και 2 osmol/L Cl).
Ανάλογα με τα χαρακτηριστικά του περιβάλλοντος περιβάλλοντος, η ωσμωτικότητα ενός δεδομένου διαλύματος μπορεί να λάβει τρεις διαφορετικές μορφές. Ισωσμωτική, υπερωσμωτική και υποωσμωτική. Όταν η οσμωτική πίεση του συγκεκριμένου διαλύματος είναι ίση με το περιβάλλον του, ονομάζεται ισωσμωτική λύση. Μια λύση είναι η υπερωσμωτική αν η ωσμωτική του πίεση είναι μεγαλύτερη από το περιβάλλον του. Ομοίως, μια λύση ονομάζεται υποωσμωτική εάν η οσμωτική του πίεση είναι χαμηλότερη από το περιβάλλον του.
Τι είναι το Tonicity
Σε αντίθεση με την ωσμωτικότητα, η τονικότητα επηρεάζεται από τις διαλυμένες ουσίες που δεν διασχίζουν τη μεμβράνη. Επομένως, είναι ένα μέτρο της βαθμίδας της οσμωτικής πίεσης και όχι η ίδια η οσμωτική πίεση. Η έννοια της τονικότητας είναι χρήσιμη για την περιγραφή των αντιδράσεων και της συμπεριφοράς ενός κυττάρου βυθισμένου σε διαφορετικές αντοχές συγκεντρώσεων. Εάν ένα κύτταρο τοποθετηθεί σε ισοτονικό διάλυμα, η συγκέντρωση του διαλύματος είναι παρόμοια με τη συγκέντρωση του κυτταρικού περιεχομένου. Επομένως, δεν θα υπάρξει εισροή ή εκροή των μορίων του διαλύτη μέσω της ημιπερατής μεμβράνης. Ωστόσο, εάν το κύτταρο τοποθετηθεί σε διάλυμα που είναι υπερτονικό, η συγκέντρωση του διαλύματος είναι μεγαλύτερη από τη συγκέντρωση του κυτταρικού περιεχομένου. Επομένως, τα μόρια του διαλύτη (σε αυτήν την περίπτωση το νερό του), θα ρέουν έξω από το κύτταρο έως ότου οι συγκεντρώσεις είναι ίσες και στις δύο πλευρές της μεμβράνης, προκαλώντας τη συρρίκνωση της. Ομοίως, εάν το κύτταρο τοποθετηθεί σε ένα υποτονικό διάλυμα, καθώς η συγκέντρωση του διαλύματος είναι χαμηλότερη από αυτή του κυτταρικού περιεχομένου, θα υπάρξει εισροή νερού στο κελί, προκαλώντας τη διόγκωση του κυττάρου και την έκρηξη τελικά.
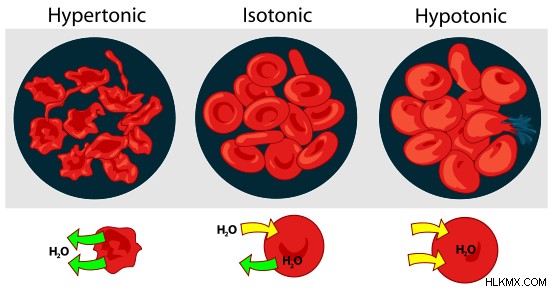
Επίδραση διαφορετικών διαλυμάτων στα αιμοσφαίρια
Διαφορά μεταξύ ωσμωτικότητας και τονικότητας
Ορισμός
ωσμωτικότητα είναι ένα μέτρο της ωσμωτικής πίεσης ενός δεδομένου διαλύματος.
Τονικότητα είναι ένα μέτρο της βαθμίδας οσμωτικής πίεσης μεταξύ δύο διαλυμάτων που χωρίζονται από μια διαπερατή μεμβράνη.
Μονάδες μέτρησης
ωσμωτικότητα μετριέται σε osmol/L.
Τονικότητα σχετίζεται με μετρήσεις συγκέντρωσης και εκφράζεται σε mol/L.
Ορισμός συγκέντρωσης
Οσμωτικότητα λαμβάνει υπόψη τον συνολικό αριθμό των διαλυμένων ουσιών που διεισδύουν και δεν διεισδύουν στη μεμβράνη.
Τονικότητα λαμβάνει υπόψη τη συγκέντρωση που σχετίζεται με τις μη διαπερατές ουσίες.
Επίδραση του περιβάλλοντος χώρου
ωσμωτικότητα συχνά αντιπροσωπεύει την ανάλυση μιας δεδομένης λύσης.
Τονικότητα χρησιμοποιείται ως μέτρο του εξωτερικού περιβάλλοντος.