Γιατί υπάρχουν στοιχεία αν έχουν τόσο σύντομο χρόνο ημιζωής;
Υπάρχουν στοιχεία με σύντομο χρόνο ημιζωής επειδή κάθε στοιχείο έχει σταθερά ισότοπα και τα ισότοπα αποσύνθεσης os δημιουργούν επίσης περισσότερα ισότοπα.
Ορισμένα στοιχεία έχουν εξαιρετικά σύντομο χρόνο ημιζωής, έτσι ώστε να αποσυντίθενται με πολύ γρήγορο ρυθμό. Είναι φυσικό να αναρωτιόμαστε γιατί υπάρχουν στοιχεία ακόμη και όταν έχουν τόσο σύντομο χρόνο ημιζωής.
Για να κατανοήσουμε την επιστήμη πίσω από αυτό, είναι επιτακτική ανάγκη να κατανοήσουμε πρώτα ορισμένες βασικές έννοιες, όπως τα ισότοπα, οι χρόνοι ημιζωής και η ραδιενεργή διάσπαση. Όταν τα άτομα του ίδιου στοιχείου έχουν διαφορετικό αριθμό νετρονίων, είναι γνωστά ως ισότοπα.
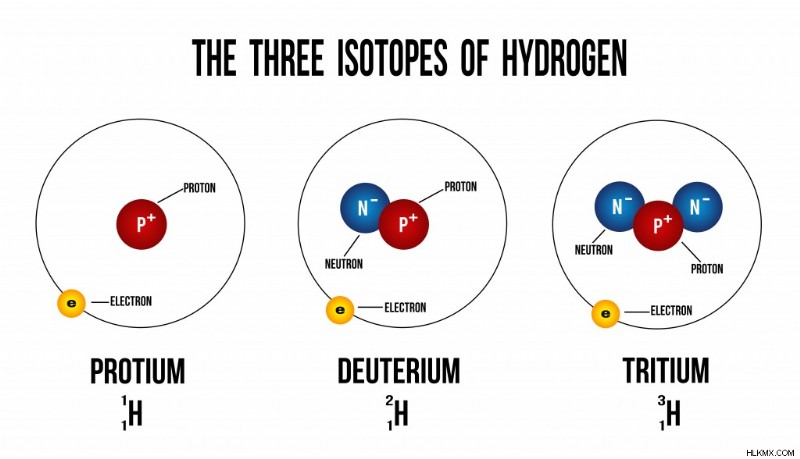
Ισότοπα Υδρογόνου (Φωτογραφία:ducu59us/Shutterstock)
Η εικόνα που φαίνεται παραπάνω απεικονίζει πώς επιπλέον νετρόνια δημιουργούν διαφορετικά ισότοπα υδρογόνου. Τα ισότοπα έχουν τον ίδιο αριθμό ηλεκτρονίων και επομένως έχουν τις ίδιες χημικές ιδιότητες. Υπάρχει, ωστόσο, μια διαφορά στις φυσικές ιδιότητες του στοιχείου λόγω της διαφοράς τους στη μάζα (αριθμός νετρονίων).
Τι είναι η ημιζωή;

Ραδιενεργή αποσύνθεση (Πιστοποίηση φωτογραφίας:OSweetNature/Shutterstock)
Όταν ένα άτομο υφίσταται ραδιενεργή διάσπαση, χάνει σωματίδια. Το χαμένο σωματίδιο θα αλλάξει το αρχικό άτομο σε διαφορετικό ισότοπο ή στοιχείο, καθώς μειώνει την ποσότητα του αρχικού στοιχείου.
"Ο χρόνος ημιζωής είναι ο χρόνος που χρειάζεται για να πέσει στο μισό της αξίας του ο αριθμός των ραδιενεργών πυρήνων που υπάρχουν σε ένα δείγμα ανά πάσα στιγμή." (Steve Owen, 2014)
Με πιο απλά λόγια, ο χρόνος που απαιτείται για να χάσει ένα στοιχείο τη μισή του μάζα είναι ο χρόνος ημιζωής του στοιχείου.
Για παράδειγμα, ένα ισότοπο φωσφόρου (32P) έχει χρόνο ημιζωής δεκατεσσάρων ημερών. Εάν είχαμε είκοσι γραμμάρια αυτού του ισοτόπου, μετά από δεκατέσσερις ημέρες, θα μας έμεναν μόνο δέκα γραμμάρια, καθώς η μισή αρχική μάζα θα είχε αποσυντεθεί. Μετά από άλλες δεκατέσσερις μέρες θα μας έμεναν πέντε γραμμάρια. Το παρακάτω διάγραμμα δείχνει την επίδραση των χρόνων ημιζωής σε αυτό το ισότοπο του φωσφόρου.
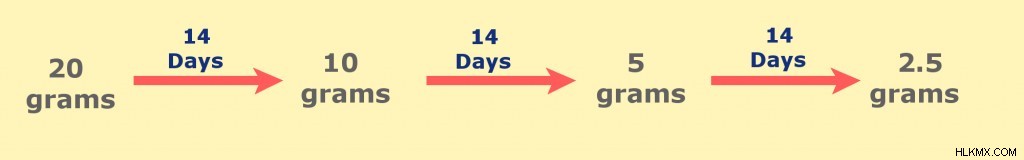
Ο χρόνος ημιζωής του φωσφόρου 32
Trajectory Half-life
Όλοι οι χρόνοι ημιζωής ακολουθούν παρόμοια τροχιά όσον αφορά τη διάσπασή τους. όπως εξηγείται, μετά από κάθε χρόνο ημιζωής, η μάζα του στοιχείου μειώνεται στο μισό. Το γράφημα που προκύπτει είναι μια κατηφορική γραμμή με φθίνουσα (απόλυτη) κλίση. Το παρακάτω γράφημα απεικονίζει την προαναφερθείσα τροχιά.
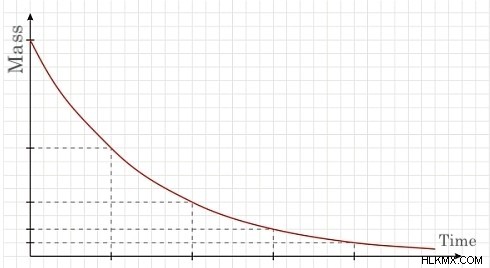
Κάθε οριοθετημένο σημείο στον οριζόντιο άξονα αντιπροσωπεύει τον χρόνο ημιζωής (χρόνος), ενώ ο άξονας Υ αντιπροσωπεύει τη μάζα (γραμμάρια) του αρχικού δείγματος του στοιχείου. Αν και το παραπάνω γράφημα απεικονίζει το γράφημα μιας τροχιάς ημιζωής, διαφορετικά ισότοπα και στοιχεία έχουν διαφορετικά μήκη ημιζωής. Η σταθερότητα ενός ατόμου επηρεάζει τη διάρκεια του χρόνου ημιζωής του.
Πώς διαφέρουν οι ημιζωές;
Η σχέση μεταξύ του χρόνου ημιζωής και της σταθερότητας του ατόμου μπορεί να απεικονιστεί χρησιμοποιώντας το παιχνίδι Jenga.

Τα διαφορετικά επίπεδα σταθερότητας που παρατηρούνται στους πύργους Jenga. (Φωτογραφία:Helga Khorimarko/Shutterstock)
Όσο πιο σταθερός είναι ο πύργος, τόσο μεγαλύτερος είναι ο αριθμός των μπλοκ που υπάρχουν στον πύργο. Ομοίως, όσο πιο σταθερό είναι ένα άτομο, τόσο μεγαλύτερος είναι ο χρόνος ημιζωής του στοιχείου.
Ο συνολικός αριθμός των κομματιών Jenga σε έναν πύργο αντιπροσωπεύει τη διάρκεια ενός χρόνου ημιζωής. Αυτή η αναλογία υποδεικνύει ότι περισσότερη αστάθεια συνδέεται άμεσα με την ύπαρξη μικρότερου χρόνου ημιζωής (λιγότερα τετράγωνα στον πύργο).
Διαφορετικά ισότοπα και στοιχεία έχουν διαφορετικό χρόνο ημιζωής με βάση τη σταθερότητά τους. Το παρακάτω γράφημα απεικονίζει τη διαφορά στις ταχύτητες αποσύνθεσης 100 γραμμαρίων αζώτου 13, άνθρακα 11 και φθορίου 18, αντίστοιχα.
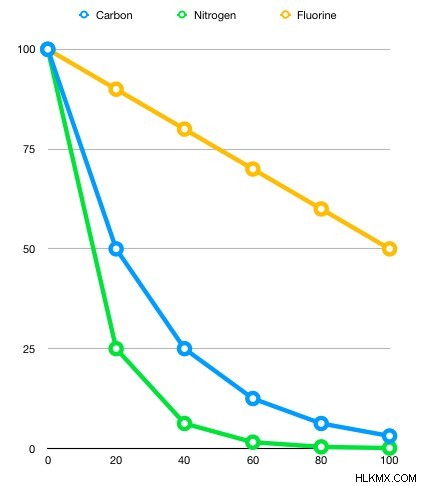
Διαδικασία αποσύνθεσης
Μπορείτε να υπολογίσετε τα μήκη ημιζωής από αυτό το γράφημα;
Μετά από είκοσι λεπτά, η μάζα του δείγματος αζώτου μειώθηκε από 100 γραμμάρια σε 25 γραμμάρια. Αυτό θα έδειχνε ότι αυτό το δείγμα είχε δύο ημιζωές. Το δείγμα άνθρακα 11 από την άλλη μειώθηκε στο μισό σε 20 λεπτά, υποδεικνύοντας ότι τα 20 λεπτά είναι η κατά προσέγγιση διάρκεια ημιζωής του. Το δείγμα φθορίου 18 μειώθηκε στο μισό σε διάστημα 100 λεπτών, υποδηλώνοντας ότι ο χρόνος ημιζωής του είναι επομένως 100 λεπτά.
Αυτό το παράδειγμα παρουσιάζει διαφορετικά μήκη ημιζωής και τη διαδικασία αποσύνθεσής τους με την πάροδο του χρόνου. Ο χρόνος ημιζωής ποικίλλει από χρόνια σε κλάσματα δευτερολέπτων. Οι επιστήμονες ισχυρίζονται ότι οποιοδήποτε στοιχειακό δείγμα ουσιαστικά «εξαφανίζεται» μετά από δέκα ημιζωές.
Μικρές ημιζωές =ανύπαρκτα στοιχεία;
Με ορισμένα στοιχεία να έχουν πολύ μικρό χρόνο ημιζωής, είναι δίκαιο να πιστεύουμε ότι τα άτομα ορισμένων στοιχείων θα υποστούν ραδιενεργό διάσπαση με τόσο γρήγορο ρυθμό που γρήγορα παύουν να υπάρχουν. Αν και αυτό μπορεί να φαίνεται ανησυχητικό, υπάρχουν πολλοί λόγοι για τους οποίους τα στοιχεία θα υπάρχουν πάντα, ακόμα και όταν ο χρόνος ημιζωής τους είναι πολύ σύντομος.
Όλα τα στοιχεία έχουν πολλαπλά ισότοπα που ποικίλλουν ως προς τον χρόνο ημιζωής. Αν και ορισμένα ισότοπα ενός στοιχείου μπορεί να έχουν μικρό χρόνο ημιζωής, υπάρχουν πάντα πιο σταθερά ισότοπα που δεν διασπώνται. Ο παρακάτω πίνακας επισημαίνει τους διαφορετικούς χρόνους ημιζωής των ισοτόπων άνθρακα:
<πίνακας>Όλα τα στοιχεία ακολουθούν παρόμοια τάση με αυτή του άνθρακα. Τα ισότοπα μπορεί να έχουν σύντομο χρόνο ημιζωής, αλλά σταθερά ισότοπα θα υπάρχουν πάντα. Αυτό διασφαλίζει ότι το ίδιο το στοιχείο δεν θα εξαφανιστεί ποτέ από την ύπαρξη.
Ένας άλλος λόγος που τείνουν να υπάρχουν στοιχεία είναι ότι η διάσπαση ενός ισοτόπου οδηγεί στη δημιουργία ενός άλλου. Όταν τα ισότοπα υφίστανται ραδιενεργό διάσπαση, ο αριθμός των πρωτονίων και των νετρονίων στον πυρήνα τους αλλάζει. Όταν ο αριθμός των πρωτονίων στον πυρήνα ενός ατόμου αλλάζει, γίνεται άτομο ενός διαφορετικού στοιχείου. Για παράδειγμα, όταν ο άνθρακας-15 υφίσταται έναν τύπο αποσύνθεσης γνωστό ως βήτα διάσπαση, μετατρέπεται σε ισότοπο αζώτου 15. Λόγω αυτής της συνεχιζόμενης διαδικασίας, τα ισότοπα υφίστανται ταυτόχρονα διάσπαση, ενώ σχηματίζονται επίσης. Έτσι, όταν ένα ισότοπο ενός στοιχείου διασπάται για να σχηματίσει ένα άλλο ισότοπο του ίδιου στοιχείου, αυτό το στοιχείο εξακολουθεί να υπάρχει!
Συμπερασματικά, ανεξάρτητα από το πόσο σύντομος είναι ο χρόνος ημιζωής, όλα τα στοιχεία έχουν σταθερά ισότοπα και συχνά σχηματίζονται ως αποτέλεσμα άλλων δραστηριοτήτων αποσύνθεσης. Η ταχύτητα της διαδικασίας αποσύνθεσης, ανεξάρτητα από το πόσο σύντομος μπορεί να είναι ο χρόνος ημιζωής, δεν θα οδηγήσει ποτέ στην εξαφάνιση ενός στοιχείου.




