Διαφορά μεταξύ αλκυλίωσης και ακυλίωσης
Κύρια διαφορά – Αλκυλίωση έναντι ακυλίωσης
Η αλκυλίωση είναι μια μεταφορά αλκυλομάδας από ένα μόριο σε άλλο χρησιμοποιώντας έναν αλκυλιωτικό παράγοντα. Αυτοί οιαλκυλιωτικοί παράγοντες έχουν την ικανότητα ναπροσθέσουν μια επιθυμητή αλυσίδα αλειφατικού υδρογονάνθρακα στο αρχικό υλικό. Σε αντίθεση με την αλκυλίωση, η ακυλίωση είναι η διαδικασία προσθήκης μιας ακυλ ομάδας σε μια ένωση χρησιμοποιώντας έναν παράγοντα ακυλίωσης. Αυτοί οι ακυλιωτικοί παράγοντες έχουν τη δυνατότητα να προσθέσουν την επιθυμητή ομάδα RCO στο αρχικό υλικό. Αυτή είναι η κύρια διαφορά μεταξύ αλκυλίωσης και ακυλίωσης.
Τι είναι η αλκυλίωση
Η αλκυλίωση είναι η διαδικασία εισαγωγής της αλυσίδας υδρογονάνθρακα στο αρχικό υλικό. Οι υδρογονάνθρακες είναι ο πιο κοινός τύπος οργανικών ενώσεων, που αποτελούνται από άτομα άνθρακα και υδρογόνου. Η προσθήκη ενός ατόμου άνθρακα (ομάδα μεθυλίου) στο αρχικό υλικό είναι γνωστή ως μεθυλίωση.
Η ομάδα αλκυλίου μπορεί να μεταφερθεί ως καρβοκατιόν αλκυλίου, ελεύθερη ρίζα, καρβανιόν ή καρβίνη. Επομένως, οι αλκυλιωτικοί παράγοντες μπορούν να χωριστούν κυρίως σε δύο κατηγορίες με βάση τον ηλεκτροφιλικό και τον πυρηνόφιλο χαρακτήρα τους. Οι πυρηνόφιλοι αλκυλιωτικοί παράγοντες σχηματίζουν ένα ανιόν αλκυλίου (καρβανιόν) κατά τη διάρκεια της αντίδρασης και επιτίθενται σε άτομο άνθρακα με ανεπάρκεια ηλεκτρονίων όπως η ομάδα καρβονυλίου. (Π.χ.:αντιδραστήρια Grignard, οργανολιθίου, οργανοχαλκού και οργανονατρίου). Ηλεκτρόφιλοι αλκυλιωτικοί παράγοντες σχηματίζουν ένα κατιόν αλκυλίου (καρβοκατιόν) κατά τη διάρκεια της αντίδρασης (π.χ.:αλκυλοελίδια). Οι ακόλουθες αντιδράσεις απεικονίζουν τον μηχανισμό για την αλκυλίωση του βενζολίου από την Friedel-crafts.
Βήμα 1: Το αλκυλαλογονίδιο αντιδρά με το οξύ Lewis για να δημιουργήσει περισσότερο ηλεκτροφιλικό άνθρακα. 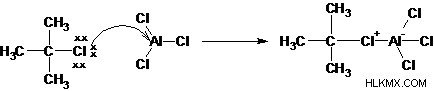
Βήμα 2: Η απομάκρυνση του αλογονιδίου δημιουργεί ένα καρβοκατιόν αλκυλίου.
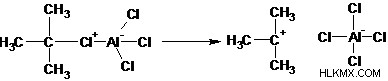
Βήμα 3: Τα π ηλεκτρόνια στον αρωματικό δακτύλιο λειτουργούν ως πυρηνόφιλα και επιτίθενται στο καρβοκατιόν χάνοντας την αρωματικότητα. 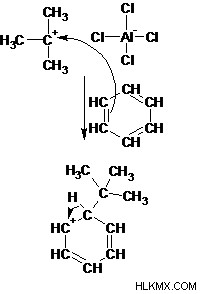
Βήμα 4: Η αφαίρεση πρωτονίου αναγεννά το αρωματικό σύστημα
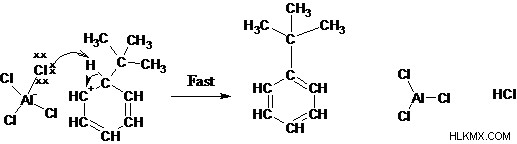
Τι είναι η ακυλίωση
Ακυλίωση είναι η διαδικασία προσθήκης μιας ακυλικής ομάδας στο αρχικό υλικό χρησιμοποιώντας έναν παράγοντα ακυλίωσης. Μια ακυλομάδα είναι μια λειτουργική ομάδα που έχει τον μοριακό τύπο του RCO.
Οι ακυλιωτικοί παράγοντες σχηματίζουν ισχυρά ηλεκτρόφιλα όταν υποβάλλονται σε επεξεργασία με μεταλλικό καταλύτη και υφίστανται εύκολα ηλεκτροφιλική υποκατάσταση. Τα ακυλοαλογονίδια είναι οι πιο συχνά χρησιμοποιούμενοι ακυλοποιητές και παράγουν κετόνες με ηλεκτροφιλική υποκατάσταση. Επιπλέον, ακυλ αλογονίδια και ανυδρίτες καρβοξυλικών οξέων χρησιμοποιούνται ως παράγοντες ακυλίωσης για την ακυλίωση αμινών και αλκοολών με πυρηνόφιλη υποκατάσταση. Οι παρακάτω αντιδράσεις απεικονίζουν τον μηχανισμό για την ακυλίωση του βενζολίου Friedel-crafts.
Βήμα 1: Το ακυλαλογονίδιο αντιδρά με το οξύ Lewis για να δημιουργήσει ένα σύμπλοκο. 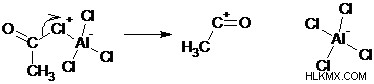
Βήμα 2: Η απώλεια αλογονιδίου από ακυλαλογονίδιο δημιουργεί ηλεκτροφιλικό ιόν ακυλίου.

Βήμα 3: Τα π ηλεκτρόνια στο βενζόλιο δρα ως πυρηνόφιλα και προσβάλλουν το ηλεκτροφιλικό ιόν ακυλίου. Αυτό το βήμα καταστρέφει την αρωματικότητα δίνοντας το ενδιάμεσο κατιόντος κυκλοεξαδιενυλίου. 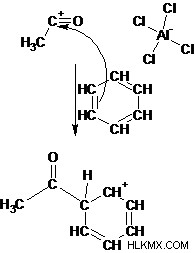
Βήμα 4: Η αφαίρεση του πρωτονίου αναγεννά το αρωματικό σύστημα και τον ενεργό καταλύτη. 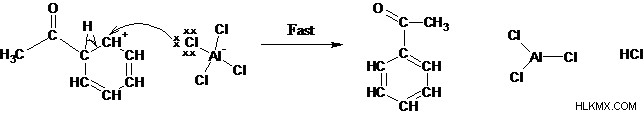
Διαφορά μεταξύ αλκυλίωσης και ακυλίωσης
Ορισμός
Αλκυλίωση :Η αλκυλίωση είναι η διαδικασία εισαγωγής της αλυσίδας υδρογονάνθρακα στο αρχικό υλικό.
Ακυλίωση :Η ακυλίωση είναι η διαδικασία προσθήκης μιας ακυλικής ομάδας στο αρχικό υλικό χρησιμοποιώντας έναν παράγοντα ακυλίωσης.
Συνολικός μετασχηματισμός
Αλκυλίωση: Ο συνολικός μετασχηματισμός είναι R-H σε R-R’.
Ακυλίωση: Ο συνολικός μετασχηματισμός είναι R-H σε R-COR’.
Αντιδραστήρια
Αλκυλίωση: Γενικά αλκυλαλογονίδια (δηλαδή R-Cl) και καταλύτης lewis όπως τριχλωριούχο αλουμίνιο (δηλαδή AlCl3 ) μπορούν να λειτουργήσουν ως αντιδραστήρια. Εναλλακτικά, μπορούν να χρησιμοποιηθούν σύμπλοκα οργανο-μετάλλων δηλ. R-MgBr αντί των αλκυλαλογονιδίων. Επιπλέον, BF3 , ZnCl2 , FeCl3 μπορεί να χρησιμοποιηθεί αντί για AlCl3.
Ακυλίωση: Γενικά τα ακυλαλογονίδια (δηλαδή R-COCl) και ο καταλύτης lewis όπως το τριχλωριούχο αργίλιο δρουν ως αντιδραστήρια. Εναλλακτικά, ανυδρίτες οξέος δηλ. (RCO)2 Το O μπορεί να χρησιμοποιηθεί αντί για ακυλαλογονίδια.
Ηλεκτρόφιλα είδη
Αλκυλίωση: Το καρβοκατιόν (δηλαδή. R ) σχηματίζεται από την «αφαίρεση» του αλογονιδίου από τον καταλύτη οξέος Lewis.
Ακυλίωση: Το κατιόν ακυλίου ή ιόν ακυλίου (δηλ.. RCO ) σχηματίζεται από την "αφαίρεση" του αλογονιδίου από τον καταλύτη οξέος Lewis.
Αναδιάταξη του Carbocation
Αλκυλίωση: Το καρβοκατιόν έχει την τάση να αναδιατάσσεται και να σχηματίζει ένα πολύ σταθερό καρβοκατιόν, το οποίο θα υποστεί την αντίδραση αλκυλίωσης.
Ακυλίωση: Το ιόν ακυλίου σταθεροποιείται από τις δομές συντονισμού. Αυτή η επιπλέον σταθερότητα αποτρέπει την αναδιάταξη του καρβοκατιόντος.
Αντιδράσεις Friedel-Craft
Αλκυλίωση: Τα αλογονίδια βινυλίου ή αρυλίου δεν υφίστανται αντίδραση αλκυλίωσης επειδή το ενδιάμεσο καρβοκατιόν τους είναι ασταθές.
Ακυλίωση: Οι αντιδράσεις ακυλίωσης δίνουν πάντα κετόνες, επειδή το HCOCl αποσυντίθεται σε CO και HCl στις συνθήκες αντίδρασης. 




