Διαφορά μεταξύ ατόμου και μορίου
Κύρια διαφορά – Άτομο εναντίον Μορίου
Τα άτομα είναι τα δομικά στοιχεία των μορίων. Τα πάντα γύρω μας αποτελούνται είτε από μόρια είτε από άτομα. Σε αυτό το άρθρο, θα συζητήσουμε τη διαφορά μεταξύ ατόμου και μορίου όσον αφορά τις χημικές καθώς και τις φυσικές τους ιδιότητες. Η κύρια διαφορά μεταξύ ατόμου και μορίου είναι το μέγεθός τους. ένα άτομο είναι το μικρότερο συστατικό ενός στοιχείου, ενώ ένα μόριο αποτελείται από δύο ή περισσότερα άτομα.
Αυτό το άρθρο εξερευνά,
1. Τι είναι ένα άτομο
– Ορισμός, Δομή, Ιδιότητες
2. Τι είναι ένα Μόριο
– Ορισμός, δομή, Ιωνικοί δεσμοί, ομοιοπολικοί δεσμοί
3. Ποια είναι η διαφορά μεταξύ Ατόμου και Μορίου 
Τι είναι τα άτομα
Ένα άτομο ορίζεται ως το μικρότερο συστατικό ενός στοιχείου, το οποίο δείχνει τις χημικές ιδιότητες που σχετίζονται με το συγκεκριμένο στοιχείο. Τα άτομα μπορούν περαιτέρω να διασπαστούν σε πρωτόνια, νετρόνια και ηλεκτρόνια. Ωστόσο, αυτά τα υποατομικά σωματίδια δεν εμφανίζουν τα χημικά χαρακτηριστικά του στοιχείου όταν διαχωρίζονται. Ένα άτομο ενός συγκεκριμένου στοιχείου περιέχει σταθερό αριθμό ηλεκτρονίων, πρωτονίων και νετρονίων τις περισσότερες φορές.
Τα άτομα άνθρακα περιέχουν 6 πρωτόνια, 6 ηλεκτρόνια και 6 νετρόνια. Αυτός ο συνδυασμός υποατομικών σωματιδίων είναι μοναδικός για το C. Ωστόσο, ορισμένα στοιχεία έχουν ισότοπα. Ο άνθρακας είναι ένα τέτοιο στοιχείο. Τα ισότοπα διαφέρουν ως προς τον αριθμό των νετρονίων τους. Αυτό προκαλεί ραδιενέργεια.
Η μάζα ενός ατόμου καθορίζεται κυρίως από τα πρωτόνια και τα νετρόνια καθώς τα ηλεκτρόνια έχουν αμελητέα μάζα σε σύγκριση με αυτά. Τα πρωτόνια έχουν θετικό φορτίο ενώ τα ηλεκτρόνια και τα νετρόνια έχουν αρνητικό και ουδέτερο φορτίο, αντίστοιχα. Ο πυρήνας ενός ατόμου αποτελείται από πρωτόνια που προσκολλώνται μεταξύ τους από ουδέτερα νετρόνια για να υπερνικήσουν τις απωστικές δυνάμεις παρόμοιων φορτίων. Τα ηλεκτρόνια μπορούν να βρεθούν τυχαία σε μονοπάτια που ονομάζονται τροχιακά που περιβάλλουν τον πυρήνα.
Το άτομο δεν μπορεί να διαχωριστεί σε υποατομικά σωματίδια με χημικές αντιδράσεις, αλλά ο διαχωρισμός είναι δυνατός με πυρηνικές αντιδράσεις.
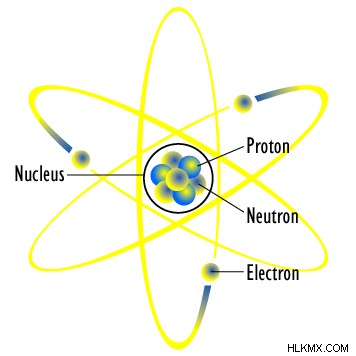
Εικόνα 1:Δομή του ατόμου
Τι είναι τα μόρια
Τα μόρια αποτελούνται από δύο ή περισσότερα άτομα που ενώνονται για να μοιράζονται ηλεκτρόνια ή να ανταλλάσσουν ηλεκτρόνια. Αυτά τα άτομα στα μόρια συγκρατούνται μεταξύ τους με διαφορετικούς τύπους δεσμών. Μόνο τα ηλεκτρόνια στο εξωτερικό περίβλημα ενός ατόμου εμπλέκονται στον δεσμό.
Ιωνικοί δεσμοί
Τα ηλεκτρόνια ανταλλάσσονται μεταξύ των ατόμων. Το άτομο που απελευθερώνει ένα ηλεκτρόνιο αποκτά θετικό φορτίο ενώ το άτομο που αποκτά το ηλεκτρόνιο είναι αρνητικά φορτισμένο. Η έλξη μεταξύ αυτών των αντίθετα φορτισμένων ιόντων ονομάζεται ιονικός δεσμός.
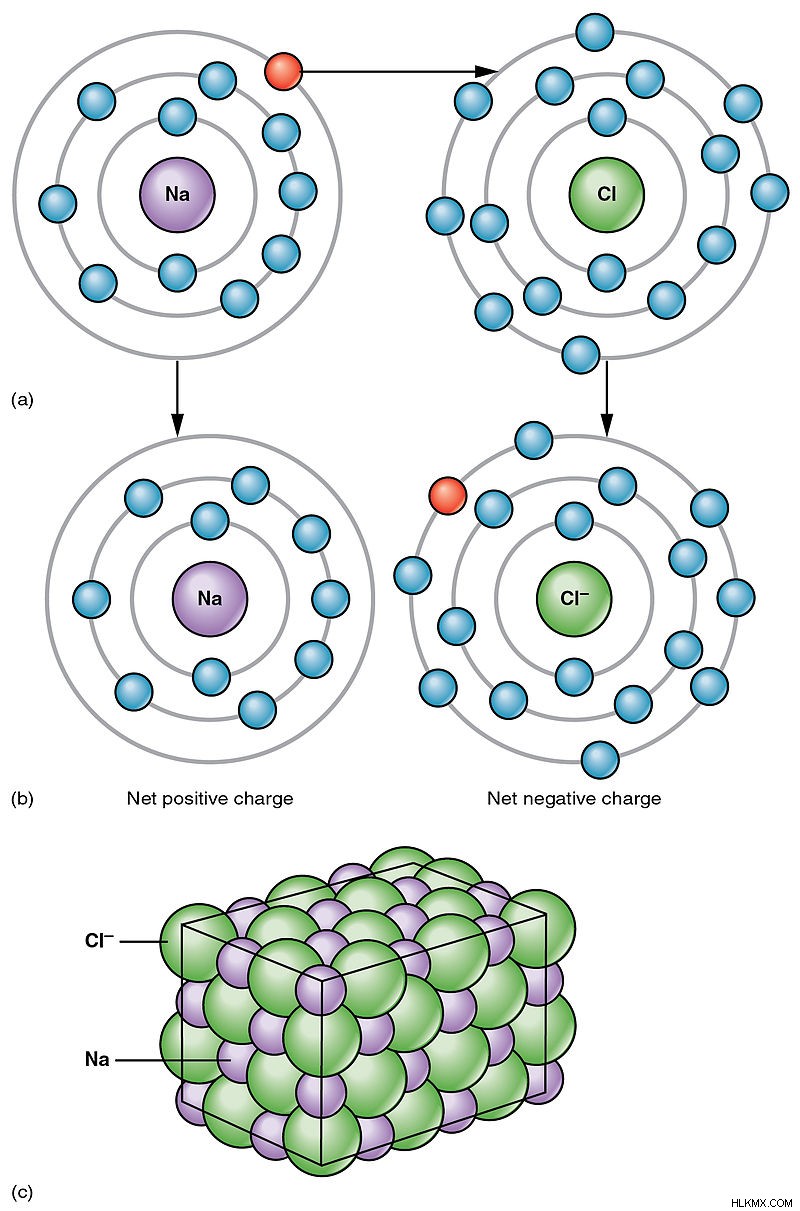
Εικόνα 2:Παράδειγμα ιοντικού δεσμού
Το παράδειγμα του χλωριούχου νατρίου δείχνει ότι ένα ηλεκτρόνιο από το Na μεταφέρεται στο Cl, αφήνοντας ένα θετικό φορτίο στο Na. Το Cl γίνεται αρνητικά φορτισμένο. Λόγω της έλξης μεταξύ αυτών των δύο αντίθετα φορτισμένων ιόντων, το NaCl θεωρείται ως ιοντικό άλας.
Ομοιοπολικοί δεσμοί
Οι ομοιοπολικοί δεσμοί σχηματίζονται με την κοινή χρήση ηλεκτρονίων μεταξύ δύο ατόμων. Επομένως, το κοινό ζεύγος ηλεκτρονίων ανήκει και στα δύο εμπλεκόμενα άτομα. Ο ομοιοπολικός δεσμός μπορεί να προκαλέσει όχι μόνο απλούς δεσμούς αλλά και πολλαπλούς δεσμούς όπως διπλούς και τριπλούς δεσμούς. (Διαβάστε:Πώς σχηματίζονται οι ομοιοπολικοί δεσμοί )
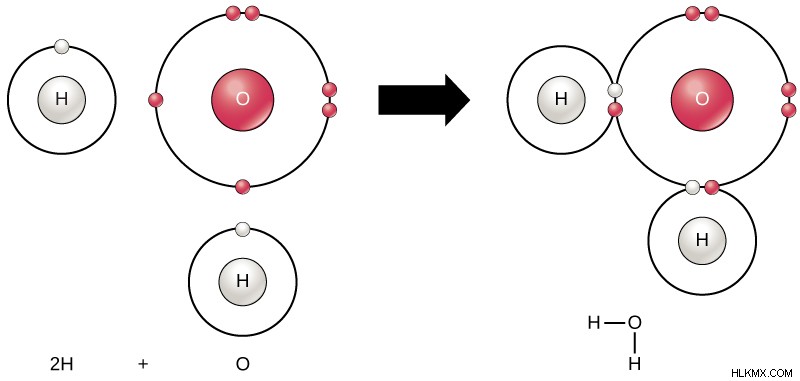
Εικόνα 3:Παράδειγμα ομοιοπολικού δεσμού
Διαβάστε περισσότερα: Διαφορά μεταξύ ομοιοπολικών και ιοντικών δεσμών
Διαφορά μεταξύ ατόμου και μορίου
Atom: Τα άτομα είναι τα δομικά στοιχεία των μορίων. Η μικρότερη μοναδική οντότητα που εμφανίζει τις χημικές ιδιότητες του αντίστοιχου στοιχείου.
Μόριο: Τα μόρια αποτελούνται από δύο ή περισσότερα στοιχεία. Δεν εμφανίζουν τις επιμέρους ιδιότητες των συστατικών στοιχείων.
Στοιχεία
Atom: Τα άτομα αποτελούνται από υποατομικά σωματίδια:πρωτόνια, ηλεκτρόνια, νετρόνια.
Μόριο: Τα μόρια αποτελούνται από περισσότερα από δύο άτομα που μπορεί να είναι είτε από το ίδιο στοιχείο είτε από διαφορετικά στοιχεία.
Σταθερότητα
Atom: Τα άτομα δεν είναι σταθερά μόνα τους και δημιουργούν χημικούς δεσμούς με άλλα άτομα για να γίνουν σταθερά.
Μόριο: Τα μόρια είναι σταθερά μόνα τους.
Διαχωρισμός
Atom: Τα άτομα δεν μπορούν να διαχωριστούν σε υποατομικά σωματίδια με χημικές αντιδράσεις. Ο διαχωρισμός είναι δυνατός μόνο με πυρηνικές αντιδράσεις.
Μόριο: Τα μόρια μπορούν να διαχωριστούν σε άτομα με χημικές αντιδράσεις.
Συμπέρασμα
Τα άτομα και τα μόρια είναι οι ιδρυτικές οντότητες του σύμπαντος. Όπως συζητήσαμε προηγουμένως, τα άτομα αποτελούν μόρια. Ωστόσο, οι χημικές ιδιότητες των ατόμων δεν διατηρούνται συχνά όταν σχηματίζουν μόρια. Για παράδειγμα, το Na είναι ένα μέταλλο υψηλής αντίδρασης ενώ το Cl είναι ένα τοξικό αέριο. Ωστόσο, το επιτραπέζιο αλάτι (NaCl) δεν είναι ούτε μέταλλο ούτε τοξικό. Αυτό δείχνει ότι οι χημικές ιδιότητες των ατόμων αλλάζουν όταν γίνονται μόρια.
Τα μόρια μπορούν να διαχωριστούν στα συστατικά τους άτομα με χημικά μέσα. Αυτό δεν είναι δυνατό με τα άτομα. Τα άτομα μπορούν να διαχωριστούν σε υποατομικά σωματίδια με πυρηνικές αντιδράσεις.
Τα μόρια μπορούν να υπάρχουν από μόνα τους και συχνά είναι σταθερά. Ωστόσο, αυτό δεν ισχύει για τα άτομα. Μόνο τα άτομα που έχουν διαμόρφωση ευγενών αερίων μπορούν να είναι σταθερά μόνα τους. Το αργό, το ήλιο, το κρυπτό κ.λπ. είναι μερικά παραδείγματα τέτοιων ατόμων. Ο λόγος της σταθερότητάς τους είναι ότι έχουν φτάσει στο μέγιστο αριθμό ηλεκτρονίων στο εξωτερικό τους περίβλημα. Ως εκ τούτου, δεν εμφανίζουν καμία χρέωση. Ωστόσο, τα άτομα που δεν έχουν αυτό το είδος σταθερότητας ενώνονται για να μοιραστούν ή να μεταφέρουν ηλεκτρόνια για να δημιουργήσουν μόρια και να γίνουν σταθερά.




