Τι είναι οι υδρογονάνθρακες; Φόρμουλες &Παραδείγματα
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε για τους υδρογονάνθρακες, τις δομές τους και τις αντιδράσεις οργανικής χημείας που σχετίζονται με αυτούς.
Τι είναι υδρογονάνθρακας;
Ο υδρογονάνθρακας είναι ένας τύπος χημικής ένωσης που περιέχει μόνο άτομα άνθρακα και υδρογόνου. Παρά αυτή την απλότητα, οι υδρογονάνθρακες είναι μια απίστευτα ποικιλόμορφη ομάδα ενώσεων. Υπάρχουν τρεις τύποι υδρογονανθράκων, ο καθένας με μοναδικά και κοινά χαρακτηριστικά. Αυτά είναι αλκάνια, αλκένια και αλκίνια.
Ονομασία υδρογονανθράκων
Και οι τρεις τύποι υδρογονανθράκων έχουν το ίδιο σχήμα ονομασίας. Το πρόθεμα του ονόματος ενός υδρογονάνθρακα προέρχεται από τον μεγαλύτερο αριθμό ατόμων άνθρακα που έχει σε μία μόνο αλυσίδα. Το δεύτερο μέρος του ονόματος εξαρτάται από το είδος των δεσμών που υπάρχουν στην ένωση. Το όνομα έχει επίθημα -ane αν υπάρχουν μόνο απλοί δεσμοί. Εάν υπάρχει διπλός δεσμός, το όνομα έχει επίθημα -ene. Με τριπλό δεσμό, το όνομα έχει επίθημα -yne.
Προθέματα
Τα παρακάτω είναι μερικά από τα κοινά προθέματα υδρογονανθράκων:
| Αριθμός ανθράκων | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Πρόθεμα | Μεθ | Eth | Στήριγμα | Αλλά | Πεντ | Εξάγωνο | Hept | Οκτώβριος |
Κλάδοι σε υδρογονάνθρακες
Μια βραχύτερη αλυσίδα υδρογονάνθρακα που συνδέεται με μια μακρύτερη ονομάζεται αλκυλομάδα, κλάδος ή υποκαταστάτες. Κατά την ονομασία του υδρογονάνθρακα, οι κλάδοι αριθμούνται με τον άνθρακα της κύριας αλυσίδας με τον οποίο συνδέεται και παίρνουν το πρόθεμα που αντιστοιχεί στον αριθμό των ανθράκων του.
Εάν ο ίδιος υποκαταστάτης εμφανίζεται πολλές φορές, κάθε θέση του στην κύρια αλυσίδα λαμβάνει έναν αριθμό και προστίθεται ένα άλλο πρόθεμα που υποδεικνύει τον αριθμό των φορών που εμφανίζεται.
Στερεοχημεία σε μόρια υδρογονανθράκων
Διαμόρφωση R και S
Ο προσδιορισμός της στερεοχημείας είναι ένα σημαντικό μέρος της ταξινόμησης και της ονομασίας των υδρογονανθράκων. Όταν ένας άνθρακας έχει τέσσερις διαφορετικές ομάδες συνδεδεμένες σε αυτόν, ονομάζεται στερεόκεντρο. Τα στερεόκεντρα λαμβάνουν μια ετικέτα R ή S ανάλογα με το πώς είναι τοποθετημένες οι ομάδες γύρω τους. Το πρώτο βήμα για τον προσδιορισμό της διαμόρφωσης R ή S είναι η επισήμανση των ομάδων με σειρά προτεραιότητας. Για τους υδρογονάνθρακες, οι ομάδες στο στερεόκεντρο λαμβάνουν έναν αριθμό από το 1 έως το 4 με βάση το μέγεθός τους. Οι μεγαλύτερες ομάδες λαμβάνουν μικρότερους αριθμούς και το υδρογόνο λαμβάνει πάντα 1.
Η ομάδα χαμηλότερης προτεραιότητας πρέπει να βρίσκεται σε διακεκομμένο δεσμό, στραμμένο προς τα πίσω. Στη συνέχεια, ένα κυκλικό βέλος θα πρέπει να σχεδιαστεί γύρω από το στερεόκεντρο που ξεκινά από την ομάδα 1 και τελειώνει στην ομάδα 3. Εάν το βέλος πηγαίνει δεξιόστροφα, το στερεόκεντρο έχει μια διαμόρφωση R. Εάν πηγαίνει αριστερόστροφα, το στερεόκεντρο έχει διαμόρφωση S. Το R ή το S μπαίνει σε παρένθεση πριν από το υπόλοιπο όνομα της ένωσης.
Εάν δύο ομάδες έχουν τον ίδιο αριθμό ανθράκων, αλλά μία από τις ομάδες έχει διπλό ή τριπλό δεσμό, η ομάδα με περισσότερους δεσμούς έχει προτεραιότητα.
Στερεοχημεία αλκενίων
Τα αλκένια έχουν επίσης στερεοχημικές εκτιμήσεις στην ονομασία. Τα εσωτερικά αλκένια μπορούν να είναι είτε σε διαμόρφωση Ζ είτε Ε. Για να προσδιορίσετε εάν ένα αλκένιο είναι Ε ή Ζ, είναι χρήσιμο να φανταστείτε μια γραμμή που εκτείνεται προς την κατεύθυνση του δεσμού αλκενίου. Όταν οι ομάδες προτεραιότητας βρίσκονται στην ίδια πλευρά αυτής της γραμμής, το αλκένιο είναι Z. Όταν οι ομάδες προτεραιότητας βρίσκονται στις αντίθετες πλευρές της γραμμής, το αλκένιο είναι Ε.
Σε ένα αλκένιο, οι ομάδες προτεραιότητας είναι οι δύο ομάδες που αποτελούν την κύρια αλυσίδα.

Κυκλικοί υδρογονάνθρακες
Οι κυκλικοί υδρογονάνθρακες λαμβάνουν το πρόθεμα "cyclo" πριν από το υπόλοιπο όνομά τους.
Παραδείγματα μορίων και ονομάτων υδρογονανθράκων
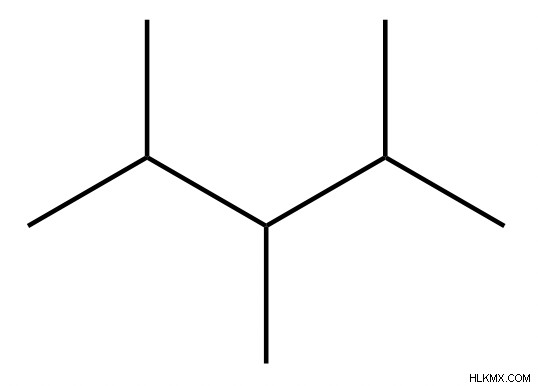

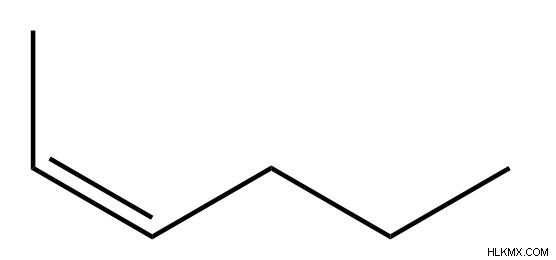
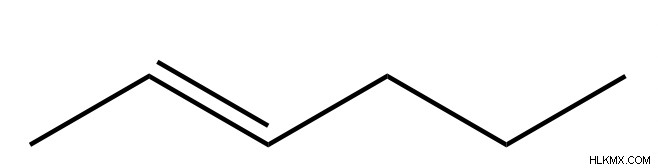

Ιδιότητες υδρογονανθράκων
Παρά τον τεράστιο αριθμό υδρογονανθράκων, όλοι μοιράζονται πολλές ιδιότητες. Επειδή δεν έχουν πολικότητα, οι μόνες διαμοριακές δυνάμεις που βιώνουν οι υδρογονάνθρακες είναι οι δυνάμεις διασποράς του Λονδίνου.
Επιπλέον, τα σημεία βρασμού και τήξης των υδρογονανθράκων αυξάνονται με τον αριθμό των ανθράκων. Η διακλάδωση μειώνει το σημείο πήξης και βρασμού μειώνοντας την απόδοση συσκευασίας. Αυτό αναφέρεται στο πόσο σφιχτά συσκευάζονται μεταξύ τους οι ενώσεις μέσα σε μια περιοχή. Το 2,3-διμεθυλεξάνιο και το οκτάνιο έχουν τον ίδιο αριθμό ατόμων άνθρακα και υδρογόνου, αλλά το οκτάνιο είναι μη διακλαδισμένο και επομένως έχει υψηλότερο σημείο βρασμού.
Όλοι οι υδρογονάνθρακες είναι εύφλεκτοι. Εκτελούν αντιδράσεις καύσης με οξυγόνο για την παραγωγή διοξειδίου του άνθρακα, υδρατμών και θερμότητας.
Το μεθάνιο, ο μικρότερος υδρογονάνθρακας, είναι αέριο του θερμοκηπίου. Αυτό σημαίνει ότι όταν συλλέγονται μεγάλες ποσότητες στην ατμόσφαιρα, παγιδεύουν τη θερμική ενέργεια από τον ήλιο.
Χρήσεις υδρογονανθράκων
Οι υδρογονάνθρακες όλων των τύπων εκτελούν ποικίλες λειτουργίες τόσο στη βιομηχανική όσο και στην καθημερινή χρήση. Πολλές από αυτές τις χρήσεις είναι είτε μέρος είτε άμεσο αποτέλεσμα της βιομηχανίας ορυκτών καυσίμων.
Καύσιμα
Οχήματα με κινητήρες εσωτερικής καύσης, όπως αυτοκίνητα, φορτηγά και αεροπλάνα, χρησιμοποιούν υδρογονάνθρακες ως καύσιμο. Αυτά τα καύσιμα δεν είναι συνήθως μια ενιαία ένωση, αλλά ένα μείγμα υδρογονανθράκων παρόμοιου μεγέθους. Τα μεγαλύτερα οχήματα τείνουν να χρησιμοποιούν μεγαλύτερα καύσιμα.
Υδρογονάνθρακες με μήκος αλυσίδας από 18 έως 50 άνθρακες χρησιμοποιούνται ως λάδι κινητήρα, το οποίο λιπαίνει τον κινητήρα και του επιτρέπει να λειτουργεί ομαλά.
Πλαστικά
Δεν είναι όλα τα πλαστικά υδρογονάνθρακες, αλλά πολλά κοινά είναι. Το πολυστυρένιο, κοινώς γνωστό ως φελιζόλ, αποτελείται από στυρόλιο πολυμερισμένο σε μακριές αλυσίδες. Ο πολυμερισμός του προπυλενίου και του πολυαιθυλενίου αποδίδει επίσης πλαστικά που χρησιμοποιούνται στις συσκευασίες.
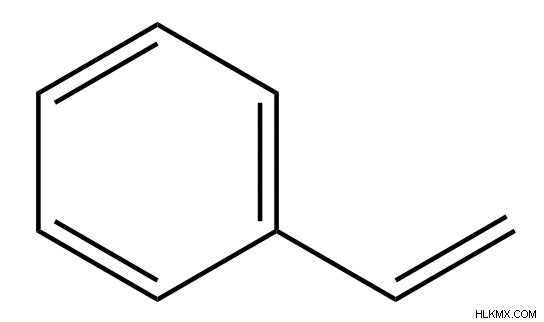
Διαλύτες
Σε εργαστήρια σε όλο τον κόσμο, οι χημικοί χρησιμοποιούν υδρογονάνθρακες ως μη πολικούς διαλύτες. Τα εξάνια και το τολουόλιο είναι δύο κοινοί διαλύτες στα οργανικά εργαστήρια. Οι χημικοί του παρελθόντος χρησιμοποιούσαν συχνά το βενζόλιο ως διαλύτη, αν και τώρα θεωρείται πολύ καρκινογόνο για χρήση σε τόσο μεγάλες ποσότητες.
Αντιδράσεις
Αλκάνια
Τα αλκάνια συμμετέχουν στους λιγότερους τύπους αντιδράσεων. Όταν εκτίθενται σε οξυγόνο, τα αλκάνια μπορούν να καούν για να παράγουν CO2 , υδρατμούς και θερμότητα. Επιπλέον, τα αλκάνια μπορούν να υποστούν αντιδράσεις αλογόνωσης. Αυτά περιλαμβάνουν την αντικατάσταση ενός ατόμου υδρογόνου με ένα αλογόνο. Τα αλκάνια μπορούν επίσης να διασπαστούν και να συνδεθούν με τη βοήθεια μεταλλικών καταλυτών.
Αλκένια
Τα αλκένια έχουν περισσότερες δυνατότητες όσον αφορά την αντίδραση. Τα μόρια αλογονιδίου και τα υδραλογονίδια μπορούν να προστεθούν κατά μήκος ενός διπλού δεσμού για να σχηματίσουν ένα αλκυλαλογονίδιο. Ομοίως, ένα μόριο υδρογόνου μπορεί να ενυδατώσει τον διπλό δεσμό με τη βοήθεια ενός μεταλλικού καταλύτη.
Η προσθήκη νερού ή αλκοόλης παρουσία οξέος θα προσθέσει, αντίστοιχα, μια ομάδα -ΟΗ ή έναν αιθέρα στο αλκένιο.
Συνήθως, αυτές οι προσθήκες ακολουθούν τον κανόνα του Markovnikov. Αυτό σημαίνει ότι το υδρογόνο θα προστεθεί στη λιγότερο υποκατεστημένη πλευρά του αλκενίου. Η χρήση βορανίου και αιθέριου διαλύτη που ακολουθείται από βάση, νερό και υπεροξείδιο του υδρογόνου επιτρέπει σε μια ομάδα -ΟΗ να προστεθεί στη λιγότερο υποκατεστημένη πλευρά αντί για Υδρογόνο.
Το όζον ακολουθούμενο από έναν αναγωγικό παράγοντα διασπά το αλκένιο εντελώς στον διπλό δεσμό. Εάν το αλκένιο ήταν τερματικό, αυτό δημιουργεί δύο αλδεΰδες. Εάν το αλκένιο ήταν εσωτερικό, αυτό δημιουργεί δύο κετόνες. Όταν το όζον ακολουθείται από έναν οξειδωτικό παράγοντα, το αποτέλεσμα είναι δύο οξέα.
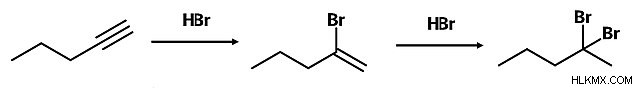
Αλκύνια
Τα αλκίνια αντιδρούν παρόμοια με τα αλκένια. Η κύρια διαφορά μεταξύ των δύο είναι ότι όπου η προσθήκη σε ένα αλκένιο δημιουργεί ένα αλκάνιο, η προσθήκη σε ένα αλκίνιο δημιουργεί ένα αλκένιο.




